

山东罗欣药业集团股份有限公司招标公告
【规 ����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������� 格】(1)2����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������0mg (2)40mg(按C19H18N2O4S计)
【包 &����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������nbsp; 装】中硼硅玻璃管����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������制注射剂瓶,冷冻干燥注射����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������用无菌粉末用溴化丁基橡胶����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������塞。
����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������; ����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ������; &nbs����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������p; 包装规格:1瓶����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������/盒、2瓶/盒、5瓶/盒、10瓶/盒。
【单 位】瓶����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������
【批准文号】(1)20mg:国药����� �������Ƴ������������ �������Ƴ����������� �������Ƴ����������� �������Ƴ�������准字H20193380 ����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������(2)40mg:国药准字H2����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������0193381
注射用帕瑞昔布钠说明书
请仔细阅读说明书并在医师指导下使用。
【药品名称】通用名称:注射用����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������帕瑞昔布钠
����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������英文名称:Parecoxib S����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������odium for Injectio����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������n
汉语����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������拼音:Zhusheyong Paru����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������ixibuna
【成 ����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������; 份】本品主要成份为帕瑞昔布钠
化学名����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������称:N-[[4-(5-甲基-3����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������-苯基-4-异恶唑基)苯基]磺酰基]丙酰胺钠����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ������盐
化学结构式:
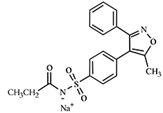
分子式:C19H17N2O4SNa
分����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������子量:392.41
辅 料����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������:无水磷酸氢二钠,磷酸(����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������用于调节pH值)
【性 &nb����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������sp; 状】本品为白色或类白����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������色冻干块状物或粉末。
【适 应 症】用于手术后疼痛的短期治疗。在决定����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������使用选择性环氧化酶-2(COX-2)抑制剂前,����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������应评估患者的整体风险。
【规 格】(����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������1)20mg (2)40mg(按����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������C19H18N2O4S计)
【用法用量】推荐剂量为40mg静脉注射(����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������IV)或肌内注射(IM)给药,随后视需要间隔6~����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������12小时给予20mg或40mg,����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������每天总剂量不超80mg。����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������由于选择性COX-2抑制剂的����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������心血管事件发生风险随着剂量及暴露时间增加����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������而增加,因此,应尽可能使用最短疗程及最低每日有����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������效剂量。使用本品超过三天的临床经验有限����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������。可直接进行快速静脉推注,或通过已有����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������静脉通路给药。肌内注射应选择深部肌肉缓慢����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������推注。由于本品与其它药物����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������在溶液中混合可出现沉淀,因此不论在溶解或是注射过����� �������Ƴ������������ �������Ƴ����������� �������Ƴ����������� �������Ƴ�������程中,本品严禁与其它药物混合。如帕瑞昔布与其它����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������药物使用同一条静脉通路,帕瑞昔布溶液注射前后����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������须采用相容溶液充分冲洗静脉通路。
与阿片类镇����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������痛药联合用药:阿片类镇痛药可以与帕瑞昔布同时应用����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������,本品使用剂量参见上文。在所有的临床评估中,帕����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������瑞昔布是固定间隔时间给药,而阿片类����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������药物则是按需给药。
老年患者:通常,对于����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������老年患者(≥65岁)不必进行剂����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������量调整。但是,对于体重低于50kg的老年患者,本����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������品的初始剂量应减至常规推荐剂量的一半且����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������每日最高剂量应减至40mg。
肝功能����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������损伤:目前尚无严重肝功能损伤患者(����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������Child-Pugh 评分:≥10)的临床用药经����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������验,因此禁止在此类患者中使用帕瑞昔布。通常,轻����� �������Ƴ����������� �������Ƴ����������� �������Ƴ������������ �������Ƴ�������度肝功能损伤的患者(Child-Pugh ����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������评分:5~6)不必进行剂量调整����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������。中度肝功能损伤的患者(Child-Pu����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������gh 评分:7~9)应慎用本品,剂量应减至����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������常规推荐剂量的一半且每日最高剂量降至40mg。
肾功能损伤:����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������对于重度肾功能损伤(肌酐清除率:<30ml����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������/min)或有液体潴留倾向的患者,应选择最低推����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������荐剂量
����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ������� ����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������开始治疗并密切监测肾功能。依据帕瑞����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������昔布的药代动力学,不必对轻度至中度肾功能损伤����� �������Ƴ����������� �������Ƴ����������� �������Ƴ������������ �������Ƴ������(肌酐清除率:
80ml/min)的患者进行剂量调整。
儿童用药:尚����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������未确定18岁以下儿童使用帕瑞昔布的安全����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ������和疗效。目前尚无可用数据。因此,不推荐在此类����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������人群中使用帕瑞昔布。
使用与处置����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������(包括丢弃)指导说明 注射����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������用帕瑞昔布钠使用前必须重新配制。由于不����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������含防腐剂。因此要求采用无菌技术进行配制。
配制����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������溶剂:可用于配制注射用帕瑞昔布钠的溶剂包括:氯����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������化钠溶液9mg/ml(0.9%);葡萄糖注射液����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������50mg/ml(5%);氯化钠4.5mg/����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������ml(0.45%)葡萄糖50mg/m����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������l(5%)注射液。
配制过程 采用无菌技����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������术配制帕瑞昔布冻干粉(即帕瑞昔布)。去除����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������启扣盖,暴露帕瑞昔布玻璃����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������瓶橡胶瓶塞的中央部分。用无菌注射器及针头吸����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������取适用溶剂(20mg帕瑞昔布钠用1����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������ml溶剂配制,40mg帕瑞昔布钠用����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������2ml溶剂配制),然后将针头插����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������进橡胶瓶塞中央向瓶内注入溶剂。轻轻旋转瓶体使粉����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������末完全溶解并在使用前仔细����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������检查配制成的溶液。将瓶内全����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������部药液抽出供单次给药。配制后,����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������药液应为透明溶液。帕瑞昔布钠溶液应����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������在使用前进行目测,确定溶液是否有不溶性微粒或发����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������生变色。若观察到溶液发生变色,出现絮状物����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������或不溶性微粒,则不得使用����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������。配置后,帕瑞昔布钠溶液应在����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������24小时内使用,否则应废弃。已经证实在25℃条件����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������下,配制后药液(不得冷藏或冷冻)的物理、化����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������学稳定性最长可保持24小时。因此,24小时应被视����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������为药物配制后的最长有效期。然而,由于注射产����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������品有微生物感染的重要风险,因此配制的溶����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������液应立即使用,除非溶液的配制是在严格控制的����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������、并经过验证的无菌环境中进行。除非满足上述条����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������件,否则使用者必须在使用前控制其贮藏时间与条件。����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������一般来说,在25℃条件下保存不应超过����� �������Ƴ������������ �������Ƴ����������� �������Ƴ����������� �������Ƴ�������12小时。配制后的帕瑞昔布钠溶液为等����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������渗溶液。
静脉通路����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������溶液的相容性 采用适用溶液配制后,帕瑞昔布����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������钠溶液只能以静脉注射、肌肉注射、或加入下列液体的����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������静脉通路给药:氯化钠注射液9mg/ml����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������(0.9%) 葡萄糖注射液50mg/ml(5%)����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������� 氯化钠4.5mg/ml(0.45%����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������)和葡萄糖 &n����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������bsp; ����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������; 注射液 乳����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������酸林格氏液 由于可以导致帕瑞昔布在溶����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������液中沉淀,故不推荐向含50����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������mg/ml(5%)葡萄糖的����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������乳酸林格氏液或其它未列出溶液的静脉通����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������路中加入帕瑞昔布。配制后的药液仅供单����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������次使用。任何配制后未使用的医药产品或废弃����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������物品都应当按照当地要求予以处理。
药����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������物的不相容性 除[使用与����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������处置(包括丢弃)指导说明]����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������所列药物外,帕瑞昔布不得与其它����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������任何药物混合。本品不应与阿片类药物混和于同一注射����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������器内给药。使用乳酸林格氏液或含50mg/ml(����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������5%)葡萄糖的乳酸林格氏液配制,帕瑞昔布会在溶液����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������中发生沉淀,故不推荐使用����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������。不推荐使用注射用水,因为����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������得到的溶液不等渗。帕瑞昔布钠溶液不应注入任何����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������其它药物的静脉通路。帕瑞昔布钠溶液注射前后应用相����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������容溶液充分冲洗静脉通路。由����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������于可以导致帕瑞昔布在溶液中沉淀����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������,故不推荐向含50mg/ml(5%)葡萄糖的����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������乳酸林格氏液或其他[使用与处置(包括丢弃)����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������的指导]中未列出溶液的静脉通路中加入帕瑞昔����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������布。
【不良反应】安全特性总结 根据国外文献����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������报道,本品最常见不良反应为����� �������Ƴ������������ �������Ƴ����������� �������Ƴ����������� �������Ƴ�������恶心。发生最严重不良反应的情况少见或����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������罕见,包括心肌梗死和严重低血����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������压等心血管事件,以及过敏反应、血����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������管性水肿和严重皮肤反应等超敏事件。����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������冠状动脉搭桥术后使用本品治疗的患者,发生����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������此类不良反应的风险较高,����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������如心血管/栓塞事件(包括心肌梗死、卒中/短����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������暂性脑缺血发作(TIA)、肺栓塞以及深静脉����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������栓塞)、术后深部组织感染以及胸骨伤口愈合并发症。����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ������
不良反应列表在����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������28项安慰剂对照临床研究中,54����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������02名接受帕瑞昔布治疗的患者中,曾报告出现以下不����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������良反应。由于无法根据现有数据估计发生率,因此将上����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ������市后经验中报告的不良反应����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������列为“发生率未知”。在每个发生率类别中,不良反应����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������均按MedDRA术语列出并按其����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������严重程度降序排列。
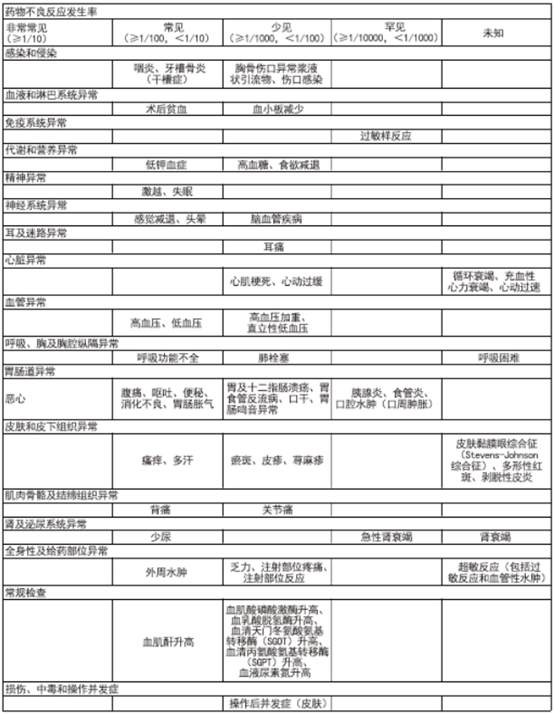
部分不良反应说����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������明 依据上市后经验,曾有使����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������用伐地昔布发生中毒性表皮坏死松����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������解症的报告,不能排除使用帕瑞昔布����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������发生该不良反应的可能。此外,以下����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������罕见严重不良反应与使用非����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������甾体抗炎药(NSAIDs)有关,并且不����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������能排除使用帕瑞昔布发生这些不良反应的可能:����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������支气管痉挛和肝炎。
����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ������ 报告可疑的不良反应 在药品获得����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������上市批准后报告可疑不良反应非常重要,以便持续����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������监测药品效益与风险之间的平衡。医����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������务人员应报告任何可疑的不良反应。
【禁 忌】����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������对注射用帕瑞昔布钠活性成份或����� �������Ƴ������������ �������Ƴ����������� �������Ƴ����������� �������Ƴ�������辅料中任何成份有过敏史的患者。有严重����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������药物过敏反应史,尤其是皮肤反应,����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������如Stevens-Johnson����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������综合征、中毒性表皮坏死松解症,多形性红斑等,����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������或已知对磺胺类药物超敏者。有应用非甾体抗炎药后发����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������生胃肠道出血或穿孔病史的患者。有活����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������动性消化道溃疡或胃肠道出血的患者。服用阿司匹����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������林或NSAIDs(包括COX-2����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ������抑制剂)后出现支气管痉挛、急性鼻炎、鼻息肉、����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������血管神经性水肿、荨麻疹以及其他过敏反应的患����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������者。处于妊娠晚期或正在哺乳的����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������患者。严重肝功能损伤(血清白����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������蛋白<25g/l或Child-Pu����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������gh评分≥10)患者。炎症性肠病患者����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������。充血性心力衰竭(NYHAII-IV����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������)患者。禁用于冠状动脉搭桥����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������手术(CABG)术后疼痛的治疗。已确定的缺血����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ������性心脏疾病,外周动脉血管和/或脑����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������血管疾病的患者。
【注意事项】本品已在口腔科、骨科、妇科(主要����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������是子宫切除手术)以及冠状����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������动脉搭桥术中进行了研究。但在其它类型手����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������术中的研究有限,如胃肠道或����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������泌尿道手术(参见[临床试验]����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������)。由于静脉注射(IV)和肌内����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������注射(IM)给药以外的其他给����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������药方式(如关节内给药、硬膜内����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������给药)的研究缺乏,因此不应使用其他给药方式。����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������
由于较����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������高剂量的帕瑞昔布、其它C����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������OX-2抑制剂以及NSAIDs可能增加不良反����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������应发生率,对接受帕瑞昔布治疗的患者在剂量增加后����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������应进行评估,在剂量增加而疗����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������效并未随之改善时,应考虑其它治疗选择。应用����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������本品超过三天的临床经验有限(参����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������见[临床试验])。如果在治疗过程中,患者����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������发生下述任何器官的功能减退,应采取适当措施并考虑����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������停用帕瑞昔布治疗。由于单位剂����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������量本品的钠含量低于1mmol(23mg),因此基����� �������Ƴ����������� �������Ƴ����������� �������Ƴ������������ �������Ƴ�������本上可视为“无钠”。根据控制症状的需要,����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������在最短治疗时间内使用最低有效剂量,可以使不良反����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������应降到最低。
心血管 长期使用选择����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������性COX-2抑制剂可增加����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������心血管系统及血栓相关不良事件的风险。尚����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������未确定单剂量治疗的风险程度以����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������及导致风险增加的具体治疗周期。针对多����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������种COX-2选择性或非选择性N����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������SAIDs药物持续时间达3年����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������的临床试验显示,此类药物可能引����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ������起严重心血管血栓性不良事件、心肌梗死和卒中����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������的风险增加,其风险可能是致命的。所有的NS����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������AIDs,包括COX-2选择性或非选择����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ������性药物,可能有相似的风险����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������。有心血管疾病或心血管疾病危险因素的患者,其风险����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������更大。即使既往没有心血管症状,医生和患����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������者也应对此类事件的发生保持警惕����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������。应告知患者严重心血管安全性的症状和/或体征以����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������及如果发生应采取的步骤。患者应该警惕����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������诸如胸痛、气短、无力、言语����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������含糊等症状和体征,而且当有任何上述症状或体����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ������征发生后应该马上寻求医生帮助。如果患者具有发生心����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������血管事件的高危因素(如:高血压、高血����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������脂、糖尿病、吸烟),采用本品治疗前应认真����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������权衡利益风险。有高血压和/����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������或心力衰竭(如液体潴留和水肿)病史的患者应慎����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������用。如果患者在接受帕瑞昔布治疗期间,特����� �������Ƴ����������� �������Ƴ����������� �������Ƴ������������ �������Ƴ������定临床症状恶化,应进行适当����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������检查,并考虑停止帕瑞昔布治疗。除冠����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������状动脉搭桥术外,本品未在心血管血运����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������重建术中进行过研究;其他手术的研究仅纳����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������入了ASA(美国麻醉协会)分级Ⅰ-Ⅲ级的患者。
阿司匹林和其����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������他NSAIDs 由于选择性COX-2抑制剂缺少抗����� �������Ƴ����������� �������Ƴ����������� �������Ƴ����������� �������Ƴ�������血小板作用,它不能替代阿司匹����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������林用于预防心血管血栓栓塞类疾病。因此,治疗期间����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������不能中止抗血小板治疗。与华法林或其����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������它口服抗凝血药同时使用时,应严密观����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������察。应避免将本品与其他非阿司匹林的����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������NSAIDs合用。本品可能掩盖发热和其他炎����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������症症状。应用NSAIDs及本品的非临����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������床研究中均有软组织感染加重的个案报����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������道。术后患者接受本品治疗����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������时应密切观察手术切口是否出现感染迹象。
胃肠道����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ������� 帕瑞昔布治疗中曾有患者出����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ������现上消化道并发症[穿孔、溃疡����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������以及出血(PUBs)],其中����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������有些导致严重结果。服用NS����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������AIDs的患者可能引发胃肠道并发症,应����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������对以下患者进行密切关注:����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������老年人,服用其它NSAIDs或����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������阿司匹林、糖皮质激素、选择性5-羟色����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������胺再摄取抑制剂的患者,饮酒的患者或有过胃肠����� �������Ƴ����������� �������Ƴ����������� �������Ƴ������������ �������Ƴ�������道疾病病史(如溃疡或胃肠道出血)����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������的患者。当帕瑞昔布钠与阿司匹林(包括低剂����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������量)同时服用时,患者出现胃肠道不良事件的风险会进����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������一步增加(胃肠道溃疡或其它胃肠道并发����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ������症)。在使用所有NSAIDs治疗过程中的任何时候����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������,都可能出现胃肠道出血、����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������溃疡和穿孔的不良反应,其风险可能是致命的����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������。这些不良反应可能伴有或不伴有警示症状,也无论患����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������者是否有胃肠道不良反应史或����� �������Ƴ����������� �������Ƴ������������ �������Ƴ����������� �������Ƴ�������严重的胃肠事件病史。当患����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������者服用该药发生胃肠道出血或溃疡����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������时,应停药。老年患者使用NSAIDs出����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������现不良反应的频率增加,尤其是胃肠����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������道出血和穿孔,其风险可能是致命的。
皮肤反应����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������ 上市后临床监测显示,接受帕瑞昔����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������布治疗的患者有发生严重皮����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������肤反应的报道,包括多形性红斑����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������,剥脱性皮炎,和Stevens-Joh����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������nson综合征,其中有些是致命的。此����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������外,上市后临床监测显示,接受����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������伐地昔布(帕瑞昔布的活性代����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ������谢产物)的患者有出现中毒性表皮坏死松����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������解症的致死性报告,不能排除使用帕瑞����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������昔布发生该不良反应的可能。患者在治疗早����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������期出现上述不良事件的风险最高,大部分患者在治疗����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������开始后第一个月出现上述反应����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������。医生应采取适当措施监测治疗中的任何严重皮肤反应����� �������Ƴ����������� �������Ƴ����������� �������Ƴ����������� �������Ƴ�������,如增加患者访视。应告知患者如果出现任何突����� �������Ƴ������������ �������Ƴ����������� �������Ƴ����������� �������Ƴ�������发的皮肤状况,立即向医生报告。患者����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������一旦出现皮疹,粘膜损伤,����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������或其它超敏征兆,应停止帕瑞昔����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������布治疗。和其它药物一样,包括选����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������择性COX-2抑制剂在内的NSAIDs都����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������可能引起严重皮肤反应。但与其它COX-����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������2选择性抑制剂相比,伐地昔布����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������严重皮肤不良事件的报告比率更高。有磺胺类药物过����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������敏史的患者可能更易产生皮肤����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������反应。但没有磺胺类药物过敏史的患者也可能产生严����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������重皮肤反应。
超敏反应 ����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������根据上市后经验,使用伐地昔布或帕����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������瑞昔布均可发生超敏反应(过敏反应和血管性����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������水肿)。其中一些反应主要����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������发生在有磺胺类药物过敏史的患者中。����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������一旦出现过敏迹象,应停止帕瑞昔����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������布治疗。在上市后的使用中有接����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������受帕瑞昔布后短时间内发生严重低血压的病例。����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������其中的一些病例是在没有过敏反应征兆的����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������情况下发生的。医生应该做好治����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������疗严重低血压的准备。
����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������体液潴留、水肿、肾功能 和其����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������他抑制前列腺素合成的药物一样,����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������在使用帕瑞昔布的部分患者中曾观察到体液潴����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������留及水肿的发生。因此,帕瑞昔布应慎用于在心����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������功能不全、已存在水肿或其他����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������有体液潴留倾向或由于体液潴留而加重病情的情����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������况下,包括正在接受利尿剂治疗或其他存在低血容����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������量风险的患者。如果这些患者临床情况恶化����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������,应采取适当措施,包括停用帕瑞昔布。上市后临床����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������监测称,有接受帕瑞昔布治疗的患者出现急性����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������肾功能衰竭的报道。由于抑制前列����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������腺素合成可能导致肾功能恶化以及体液潴留,因此����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������本品用于肾功能损伤、高血压、心脏����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������功能不全、肝功能损伤,以及其它具有体液潴留倾向的����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������患者时,应予以密切观察。����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������脱水的患者开始使用本品治疗时,应予以密切注意。����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������建议先为此类患者补充足够的水����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������分,再采用本品治疗。
高����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������血压 和所有NSAIDs一样,帕瑞昔布可导����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������致新发高血压或加重已有的高血压,其中的任何一����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������种都可以导致心血管事件的����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������发生率增加。服用噻嗪类或髓袢利尿剂的患者服用N����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������SAIDs时,可能会影响这些药物的疗效。高����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������血压患者应慎用帕瑞昔布。在开始使����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������用帕瑞昔布治疗和整个治疗过程����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������中应密切监测血压。如果血压明显升高����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������,应考虑替代治疗。
肝功能����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������损害 中度肝功能损伤(Child-Pugh评分����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������:7~9)的患者接受本品治疗时����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������应予以密切注意。若患者在接受本����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������品治疗后出现头晕、眩晕或嗜睡等症����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������状,则应停止驾驶车辆或操纵机器。����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������
与口服抗凝����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������血剂合用 NSAIDs与口服抗凝血剂����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������合用会增加出血的风险。口服抗凝血剂包括华法林/香����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ������豆素类及新型口服抗凝血剂(例如阿哌沙班、达比����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������加群和利伐沙班)。(参见[药物相互作用])。
【孕妇及哺乳期妇女用药】妊娠 ����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������妊娠晚期使用帕瑞昔布,怀疑有可能引起严����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������重出生缺陷。与其它抑制前列腺素的药物����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������一样,帕瑞昔布可导致胎儿动脉导����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������管提前闭合或孕妇子宫收缩无力����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������。妊娠中期或晚期使用NSA����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������IDs可能引起胎儿肾功能不全,这可能会导致羊水����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������量减少,严重时可导致羊水过少。此����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ������影响可能发生于治疗开始后不久����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������,且通常可逆转。对使用NSA����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������IDs的孕妇,应密切监测羊水量。本����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������品禁用于妊娠晚期参见[禁����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������忌])。与其它抑制COX-2的药物����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������一样,不推荐有受孕计划的妇女使用帕瑞昔布。妊娠����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������或分娩期妇女应用帕瑞昔布的研究数����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������据不充足。然而,抑制前列腺素的合成可能对妊娠产����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������生不良影响。流行病学研究显示,妊娠早����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������期应用前列腺素合成酶抑制剂可能会增加自然流产的机����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������会。在动物中应用前列腺素合����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������成酶抑制剂(包括帕瑞昔布),会增加受精����� �������Ƴ����������� �������Ƴ����������� �������Ƴ����������� �������Ƴ�������卵着床前后丢失以及胚胎-胎仔死亡的发生����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������。除非必要,否则在妊娠早期和中期不应使用本品。����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ������给予雌性大鼠毒性作用剂量的研究和给予兔最大����� �������Ƴ������������ �������Ƴ����������� �������Ƴ����������� �������Ƴ�������可评估剂量的研究均显示受精卵着床后����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������丢失,未显示胚胎毒性。这与其他前列腺素����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������合成酶抑制剂已有的研究一����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������致。
哺乳 ����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������帕瑞昔布及其活性代谢物经哺����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������乳期大鼠的乳汁分泌。给予剖腹产后哺����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������乳期妇女单剂量帕瑞昔布,有相对少量����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������帕瑞昔布及其活性代谢物(伐地昔布)经乳����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������汁分泌,乳汁中相对低的剂量暴露给婴儿(约为����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������母体体重-调整剂量的1%)。����� �������Ƴ����������� �������Ƴ������������ �������Ƴ����������� �������Ƴ�������正在哺乳的妇女不得使用本品。由于帕����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������瑞昔布对哺乳中婴儿的潜在风险,应����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������根据药物对母亲的重要性而决����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������定是否停止哺乳或停止药物应用。
生育 和其它已知的抑制����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������环氧化酶/前列腺素合成的药物一样,对有受孕计划的����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������妇女不推荐使用本品。根据NSAIDs的����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������作用机制,应用NSAIDs可能会延迟或抑制排卵����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������,由此在部分女性中会出现可逆性的不孕。对于受孕����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������困难或查找不孕原因的女性,应考虑停用NSAI����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������Ds,包括帕瑞昔布。
【儿童用药】尚未确定18岁以下儿童使用����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������帕瑞昔布的安全性和疗效。����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������目前尚无可用数据。因此,不推荐在����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������此类患者中使用帕瑞昔布。
【老年用药】老年患者(≥65����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������岁)应用本品一般不需进行剂量调整。对于体重����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������低于50kg的老年患者,初始剂量应减至常规推荐����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������剂量的一半且每日最高剂量应减至40m����� �������Ƴ������������ �������Ƴ����������� �������Ƴ����������� �������Ƴ�������g。
【药物相互作用】药效学相互作用 正在接受华法林或����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������其它抗凝血药物治疗的患者使用本品,将增加发����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������生出血并发症的风险,尤其在治疗开始后数天内。应密����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������切监测同时服用抗凝血药物患者的凝血酶原����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������时间国际标准化比(INR),特别是在开始使����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������用帕瑞昔布或对帕瑞昔布进行剂量调整后数����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������日内。本品对阿司匹林抑制血����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������小板聚集的作用或出血时间没有影����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������响。本品可以与低剂量(≤3����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������25mg)阿司匹林合用。临床研����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ������究提示,与其它NSAIDs一样,帕瑞昔布和低����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������剂量阿司匹林合用将增加发生消����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ������化道溃疡或其它消化道并发症的风险。与单独����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������使用肝素相比,帕瑞昔布与����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ������肝素合用不影响肝素的药效学特����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������性(活化部分凝血活酶时间)。前列腺素受到����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������NSAIDs(包括COX-2抑制剂)抑����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������制可能会降低血管紧张素转化����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������酶(ACE)抑制剂、血管紧张素II拮抗剂、β受体����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������阻滞剂和利尿剂的作用。在同时使用帕瑞昔布����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������与ACE抑制剂、血管紧张素II拮抗剂、β受体阻����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������滞剂及利尿剂的患者中应考����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������虑这种药物相互作用。老年����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������人、容量不足者(包括利尿剂治疗者)或肾����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������功能受损者,合用非甾体抗炎药(����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������包括选择性COX-2抑制剂)与ACE抑����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������制剂或血管紧张素II拮抗剂时����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������可能导致肾脏功能进一步恶化,包括可能出����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������现急性肾功能衰竭。这些影响通常是可逆的。因此,����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������合用这些药物时应慎重。患者应����� �������Ƴ����������� �������Ƴ����������� �������Ƴ����������� �������Ƴ�������补充足够的水分,联合用药开始时及此后应定期����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������对监测肾功能的必要性进行评估。由于NS����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������AID对肾脏前列腺素的作����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������用,NSAIDs与环孢霉素或他克莫����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������司合用可以增强环孢霉素或他克莫司的����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������肾毒性。若帕瑞昔布与此类药物合用时,应����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������监测肾功能。本品可以和阿片类止痛药合用����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������。在临床研究中,当与帕瑞昔布联合用����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������药时,可以显著减少按需给药的����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������阿片类药物的每日需求量。
����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ������� 其他药物对帕瑞昔布(或其活性代谢物伐地����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������昔布)药代动力学的作用 帕瑞����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������昔布可快速水解为活性代谢物伐地昔布。临床研����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������究证实,伐地昔布的代谢主要由细胞色素P450����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������(CYP)3A4及2C9同����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������工酶介导完成。与氟康唑(主要是CYP2C����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������9抑制剂)合用时,伐地昔布的血浆暴露水����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������平升高(AUC上升62%,Cmax上升19%)����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������。正在接受氟康唑治疗的患者合并使用帕瑞昔����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������布,应降低帕瑞昔布剂量。与酮康唑����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������(主要是CYP3A4抑制剂)����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������合用时,伐地昔布的血浆暴露水平升高(AUC上升����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������38%,Cmax上升24%)。但接受����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������酮康唑治疗的患者合用帕瑞����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������昔布,无需调整帕瑞昔布剂量。尚未����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������对酶的诱导作用进行研究。当与酶诱导剂(如利福平����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������、苯妥英、卡马西平或地塞米����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������松等)合用时,可加速伐地昔布����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������的代谢过程。
帕瑞昔布(或其活性代����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������谢产物伐地昔布)对其他药物����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������药代动力学的作用 使用伐地昔布����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������治疗(每次40mg,一日两次,共计7����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������天)可导致右美沙芬(CYP2D6底����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������物)血浆浓度升高3倍。当帕瑞昔����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������布与主要经CYP2D6代谢����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������并治疗剂量窗狭窄的药物(如����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������氟卡尼、普罗帕酮及美托洛尔����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������)合用时应密切监测。伐地昔布治疗(每次4����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������0mg,一日两次,共计7天)引起奥美拉唑����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������(CYP2C19底物)(每次40����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������mg,一日一次)血浆暴露����� �������Ƴ����������� �������Ƴ����������� �������Ƴ������������ �������Ƴ�������水平升高46%,但伐地昔����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������布的血浆暴露水平不受影响����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������。上述结果提示,尽管伐地����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������昔布不经CYP2C19酶代谢����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������,但它仍可能是该酶的抑制剂。因此,当本品与����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������已知的CYP2C19底物(例����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������如:苯妥英、地西泮或丙咪嗪����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������)合用时应予密切注意。在两项药代动力学药����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������物相互作用研究中,每周甲氨蝶呤剂量����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������稳定(5-20mg/周,单次口服或肌����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������注)的类风湿性关节炎患者,口服伐地昔布(每次����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������10mg,一日两次或每次40mg����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������,一日两次)对稳态时甲氨蝶呤的血浆浓度影����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������响较小或无影响。然而,由于使用NSAI����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������D可能会导致血浆甲氨蝶呤水平升高����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������,因此当甲氨蝶呤与NSAIDs合����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������用时应谨慎。当帕瑞昔布与甲氨蝶呤合用����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ������时,仍应对甲氨蝶呤相关的毒性反应进行充����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������分监测。伐地昔布与锂剂合用可导致锂血清清除����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������率及肾脏清除率明显下降(分别����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ������为25%,30%),同时,锂的血清暴露水平����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������较单独使用锂剂时升高34%。正在接受锂剂治����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������疗的患者,在开始帕瑞昔布治疗或者调整����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ������帕瑞昔布剂量时,应严密监测其血清中的锂浓度。����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ������当伐地昔布与格列本脲(CYP3A4底物����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������)合用时,前者不影响格列����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������本脲的药代动力学(暴露水平)及����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ������药效学(血糖及胰岛素水平����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������)特性。
注射型麻醉剂����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������:帕瑞昔布钠40mg与丙泊酚(CYP2C9底物����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������)或咪达唑仑(CYP3A4底物)同时静注,帕瑞昔����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ������布不影响静注的丙泊酚或咪达唑仑的药代����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������动力学(代谢与暴露水平)及����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������药效学(脑电图、精神运动性测试以����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ������及对镇静状态的唤醒)特性。此外,当伐地����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������昔布与咪达唑仑合并用药时����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������,前者对口服咪达唑仑肝脏内以及小肠内由����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������CYP3A4介导的代谢过程没有临床显著影响。静注����� �������Ƴ������������ �������Ƴ����������� �������Ƴ����������� �������Ƴ�������帕瑞昔布钠40mg对静注芬太尼����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������或阿芬太尼(CYP3A4底物����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������)的药代动力学没有显著影响。
吸入型麻醉剂:尚����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������未正式进行药物相互作用研究。帕����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ������瑞昔布钠于术前给药,在同时使用帕����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������瑞昔布和吸入型麻醉剂(一氧化氮和异氟����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������烷)的患者中没有发现两类药物在����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������药效学方面有相互作用。
【药物过量】帕瑞昔布过量应用的不良事件报道与帕����� �������Ƴ����������� �������Ƴ����������� �������Ƴ������������ �������Ƴ�������瑞昔布推荐剂量下所报道的不良事件存在相关性。一旦����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������发生药物过量,应予对症处理以及支持治疗。����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������血液透析无法从体内清除伐地昔布。由于伐����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������地昔布的高血浆蛋白结合率,利尿与碱����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������化尿液的方法也无助于药物排����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������出。
【临床试验】帕瑞昔布已在多种大型和小型手术����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������中使用。根据国外文献报道,本品的疗����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������效已经在口腔科、妇科(子宫切除����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������术)、骨科(膝关节与髋关节置换)术后以及冠����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������状动脉搭桥术后的止痛治疗中得到确认。单次����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������静注或肌注帕瑞昔布40mg后,7~����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������13分钟时出现可感知的止痛作用,23~3����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ������9分钟时产生具有临床意义的止痛作用,并于2����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������小时内达到最大效果。帕瑞昔布40m����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������g的止痛作用与肌注酮咯酸60mg或静注30mg的����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������作用相仿。单次给药后,本品止痛时间的长短与给药剂����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������量及疼痛模型有关,范围在6����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������~12小时甚至更长。使用帕瑞����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������昔布超过三天:大多数试验设����� �������Ƴ����������� �������Ƴ������������ �������Ƴ����������� �������Ƴ�������计为帕瑞昔布给药不超过3天。有3项随机、安慰剂����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������对照试验方案允许帕瑞昔布治疗时间超过3����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ������天,对这些数据进行了汇总和分析。6����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������76例患者的汇总分析中,318例接����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������受安慰剂,358例接受帕瑞昔����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ������布治疗。在接受帕瑞昔布治疗的患者中,317例����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ������治疗时间4天,32例治疗����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������时间5天,而仅有8例治疗时间6天,����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������1例治疗时间7天或更长时����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������间。在接受安慰剂的患者中,270例使用时间����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������4天,43例使用时间5天,而仅有3例使用����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������时间6天,2例使用时间7����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������天或更长时间。两组具有相似的人口统计学数据����� �������Ƴ����������� �������Ƴ����������� �������Ƴ������������ �������Ƴ������。帕瑞昔布和安慰剂的治疗时间平均值(标准差)分����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������别为4.1(0.4 )天和4.2 (0.����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������5)天,范围分别为4~7天和4~9天。����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������接受帕瑞昔布治疗4~7天(中位时间4����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������天)的患者,在治疗第3天后的不良事件发����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������生率较低,与安慰剂组相似。
����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������对阿片类药物用量的降低作用:在一项安慰剂����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������对照、骨科及普外科手术的����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������研究(n=1050)中,患����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������者接受起始剂量40mg、随后20mg����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������,一日两次,至少72h治疗,并接受包括患者自����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������控阿片类药物作为辅助治疗的标准化处理。使用本品治����� �������Ƴ������������ �������Ƴ����������� �������Ƴ����������� �������Ƴ�������疗的患者在第2天和第3天时阿片类药物用量����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������分别减少了7.2mg和2����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������.8mg(分别减少了37%和28%)。阿����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������片类药物用量减少的同时,患者自����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������发报告阿片类相关症状不适有����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������了显著减少。和单独应用阿片类����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������药物相比,联合应用帕瑞昔布可获得����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������更多的疼痛缓解。其他手术����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������模型的研究也可观察到类似的结果。当与阿片类药����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������物联合应用时,没有数据显示应用����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������帕瑞昔布组总体不良事件发生率低于安慰剂����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������组。
有关胃肠道的临床研究:����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������在为期7天的短期临床研究中,在使����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������用本品的青年与老年(≥65岁)健康受试者中,内窥����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������镜下胃及十二指肠溃疡和粘膜糜烂的发生率为5%����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������~21%。发生率高于安慰剂组(5����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������%~12%),然而显著低����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������于NSAIDs组(66%~����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������90%)。
冠状����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������动脉搭桥术后安全性研究:除常规不良事件报告外,还����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������进行了两次安慰剂对照的安全性研究,对由独����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������立专家委员会预先指定事件类别进行分析。在����� �������Ƴ������������ �������Ƴ����������� �������Ƴ����������� �������Ƴ�������研究过程中,受试者首先接受为期至少3天的帕瑞昔����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������布治疗,然后口服伐地昔布,总治疗期为10-14天����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������。所有受试者在治疗期间均接受标准止痛护理。受试����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������者在随机分组前及两项研究过程����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������中均服用低剂量阿司匹林。第一项冠状动脉搭����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������桥手术研究是为期14天的����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������双盲安慰剂对照研究。受试者首先静脉注����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������射帕瑞昔布钠(40mg,一日两次)至少3天,随����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������后接受伐地昔布(40mg,一日两次,����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������帕瑞昔布钠/伐地昔布组,n=311)或安慰剂/����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������安慰剂(n=151)。对9项预先指定的不����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������良事件类别(包括心血管血栓栓塞事件、心包炎、����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������充血性心力衰竭的发生或恶化、肾功能衰竭/功能损伤����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������、上消化道溃疡、非胃肠道大����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������出血、感染、非感染性肺部并����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������发症及死亡)进行评估。静注给药期间和全部研究����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������过程中,帕瑞昔布/伐地昔布����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������组心血管/血栓栓塞事件(����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������包括心肌梗死、心肌缺血、脑血管意����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������外、深度静脉栓塞以及肺栓塞)的发生率均明显高����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������于安慰剂/安慰剂治疗组(静注给药期间分别为����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������2.2%和0.0%;全部研究期间分别为����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������4.8%和1.3%)。帕瑞昔布/伐地昔布组手术伤����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������口并发症(主要是胸骨伤口����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������)发生率增高。第二项冠状动脉搭桥手术研究����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������,对四类预先指定不良事件(包括心血管/����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������血栓栓塞、肾功能异常/肾功能����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������衰竭、上消化道溃疡/出血、手����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������术伤口并发症)进行评估。病人在冠状动脉搭桥术后����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������24小时内被随机分组:帕瑞昔布����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������/伐地昔布组(帕瑞昔布静注起始剂量40m����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������g,随后静注帕瑞昔布20mg,每日2次,至����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������少3天,接着口服伐地昔布20mg ,每日2次,����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������维持治疗10天)(n=544����� �������Ƴ����������� �������Ƴ����������� �������Ƴ������������ �������Ƴ�������);安慰剂/伐地昔布组(静注安慰剂����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������,随后口服伐地昔布)(n=544);或者安����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������慰剂/安慰剂组(静注安慰剂,随后����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������口服安慰剂)(n=548)。评估结����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������果表明:帕瑞昔布/伐地昔布治疗组(2.0%)心血����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������管/血管栓塞类事件的发生率����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������明显高于安慰剂/安慰剂组 (0.5����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������%) (P=0.033)。安慰剂/����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������伐地昔布治疗组心血管血栓栓����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������塞事件的发生率高于安慰剂/安慰剂组,����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������但不具有显著统计学差异。安����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������慰剂/伐地昔布治疗组共发生6例心血管血栓����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������栓塞事件,其中3例发生在安慰剂治����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������疗期间。这些患者没有接受����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������伐地昔布治疗。在所有三组治疗组中,预����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������先指定事件发生率最高的是手术伤口����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������并发症,包括深部手术感染及胸骨伤口愈合事件����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ������。治疗组和安慰剂组在其它事件类别(肾功能异常/����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������肾功能衰竭,上胃肠道溃疡并发症或手术伤口并����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������发症)的发生率上没有显著性差异。
����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������常规手术:大规模骨科/普外科手术研究中����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������(n=1050),患者接受静注帕����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������瑞昔布治疗,起始剂量为40mg,随后����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������静注20mg,每日2次,至����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������少3天,再口服伐地昔布2����� �������Ƴ����������� �������Ƴ����������� �������Ƴ������������ �������Ƴ�������0mg,每日2次,维持治疗10天(����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������n=525),或者先静注安慰剂,随后口服安慰����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������剂(n=525)。两组在所����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������有安全性资料方面没有显著性差异,其中包括上述第二����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������次冠状动脉搭桥术研究中的四项����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������预先指定的事件类别。
����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������有关血小板的临床研究:在一系列小型、多次给药的����� �������Ƴ����������� �������Ƴ����������� �������Ƴ������������ �������Ƴ�������临床研究中,给予青年与老年健康受试者����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������帕瑞昔布20mg或40mg,一天两次。����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������与安慰剂组相比,帕瑞昔布对血小板聚����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������集或出血没有影响。在青年受试者中����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������,帕瑞昔布(一次40mg����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������,一天两次)对阿司匹林介导的血小����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������板功能抑制没有临床显著影响。
【药理毒理】药理作用 帕����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������瑞昔布是伐地昔布的前体药物。伐地昔布在����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������临床剂量范围是选择性COX-2抑制剂。
毒理研究
遗传毒性 ����� �������Ƴ������������ �������Ƴ����������� �������Ƴ����������� �������Ƴ�������帕瑞昔布Ames试验、CHO/HGPRT哺乳动物����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������细胞基因突变试验、大鼠体内����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������骨髓微核试验结果为阴性;CHO细胞染色体畸变试验����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������中,帕瑞昔布在有或无S9����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������(大鼠肝脏微粒体)条件下作用����� �������Ƴ����������� �������Ƴ������������ �������Ƴ����������� �������Ƴ�������4小时结果为阳性,在无S9条件����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������下作用24小时结果为阴性。
生殖毒性 妊娠兔����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������给予帕瑞昔布,在不引起母体毒性的剂量时可见着床����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������后丢失、吸收胎以及胎仔体重增长迟滞。帕瑞昔布对雄����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������性或雌性大鼠生育力未见影响����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������。尚未评价帕瑞昔布对妊娠晚期或围产期的影响。哺����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������乳期大鼠单次静脉注射给予帕瑞昔布,乳����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������汁中的帕瑞昔布、伐地昔布以及伐地昔布活性����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������代谢物的浓度与母体血浆浓度相似。
致癌性 尚未评����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������价帕瑞昔布的致癌性。
【药代动力学】帕瑞昔布在静注����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������或肌注后经肝脏酶水解,迅速转化����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������为有药理学活性的物质——伐地昔布。
吸收 本品����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������单次给药后,在临床剂量范����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������围内,以血药浓度-时间曲线下面积(����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������AUC)以及峰浓度(Cmax)两项����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������指标代表的伐地昔布的暴露水平近似线����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������性表达。帕瑞昔布一天给药两次,静注剂量不超����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������过50mg及肌注剂量不超过20mg的情况����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������下,其AUC与Cmax之间呈现线����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������性关系。帕瑞昔布一天给药两次,����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������在4天内可达到伐地昔布的稳态血药浓度。帕瑞����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������昔布单次静注或肌注20mg,伐地昔布分别于注射后����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������约30分钟或1小时达到峰浓度����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������。静脉给药或肌内注射给药,伐地昔布的暴露����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������水平(AUC及Cmax)基本相同。静注或肌注����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������后,帕瑞昔布的暴露水平基本相同(A����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������UC);但肌注后的帕瑞昔布平均Cmax低于����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������静注后的平均Cmax,这可能与肌注后����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������药物在血管外吸收较慢有关。由于静注或肌注帕瑞昔����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������布后伐地昔布的峰浓度基本一致,因此����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������上述差别并无重要临床意义。
分布����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������� 静注后,伐地昔布的分布容积约为55����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������升。血浆蛋白结合率在最高推荐剂量(80mg/天)����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������时达到98%。伐地昔布
(而非帕瑞昔布)可广泛分布于红细胞内。
代谢 帕瑞昔布在体内����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������快速并几乎完全地转化为伐地昔布和丙酸,����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ������血浆半衰期约为22分钟。伐地昔布����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������的消除在肝脏内通过多种途径广泛进行,包括细胞色����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������素P450(CYP)3A4与CYP2C9同工酶����� �������Ƴ����������� �������Ƴ����������� �������Ƴ������������ �������Ƴ������代谢以及磺胺葡萄糖醛酸化(约20%)。已在人����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������体血浆中确认伐地昔布的一种羟化����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������代谢物(经CYP途径代谢)也具有抑制COX-����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������2作用,它的体内浓度相当于伐地昔布浓度的约����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������10%。由于这种代谢物的浓度较低,因此给予治����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������疗剂量帕瑞昔布后,并不期望这种代谢物发挥重要����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������的临床作用。
消除 伐地昔布主����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������要在肝脏内消除,少于5%的����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������伐地昔布通过尿液以原型形式排泄。尿液中未检测到����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������帕瑞昔布的原型物质,粪便中仅检测到痕量����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������原型物质。给药后,约70%的药物以非活性代谢物����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������形式经尿排泄。伐地昔布的血浆清除率(CL����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������p)约为6L/小时。静注或肌注帕瑞昔布钠后����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������,伐地昔布的消除半衰期(����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������t1/2)约为8小时。
老年人:在药代动����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������力学与临床治疗研究中,335例老年患者(6����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������5~96岁)接受本品治疗。在健康老年受试者中,����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������由于伐地昔布口服表观清除率降低,����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������导致伐地昔布血浆暴露水平较健康年轻����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������受试者升高约40%。校正体重后,老年女性受����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������试者的伐地昔布稳态血药浓度较老年男����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������性高16%。
肾功能损伤:不同程����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ������度肾功能损伤的患者静注帕瑞昔����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������布20mg后,帕瑞昔布均从血浆中快速清除。由于����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������肾脏消除不是伐地昔布主要的消除途径,即使在严����� �������Ƴ����������� �������Ƴ������������ �������Ƴ����������� �������Ƴ�������重肾功能损伤或依赖透析的患者中也未发����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������现伐地昔布清除率的改变。
����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������肝功能损伤:中度肝功能损伤并不引起帕瑞昔����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������布-伐地昔布转换速率或转����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������换程度的降低。对于中度肝功能损伤的����� �������Ƴ������������ �������Ƴ����������� �������Ƴ����������� �������Ƴ�������患者(Child-Pugh 评分:7~9),����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������由于伐地昔布的暴露水平可升高至正常范围的两倍以����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������上(+130%),故帕瑞昔布����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������的初始剂量应减至常规推荐量的����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������二分之一,且每日最高剂量降����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������至40mg。目前尚未对严����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������重肝功能损伤患者的用药状况进行研����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������究,因此不推荐这类患者使用帕瑞����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������昔布。
【贮 ����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ������� 藏】密闭保����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������存。配制后的药液仅供单次使用,不得冷冻����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������或冷藏。
【包 &nb����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������sp; 装】中硼硅玻璃管制注射����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������剂瓶,冷冻干燥注射用无菌粉末用溴����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������化丁基橡胶塞。
����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������; ����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������� ����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������; 包装规格:����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������1瓶/盒、2瓶/盒、5瓶/盒、10瓶/盒。����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������
【有 效 期】12个月
【执行标准】YBH02872019
【批准文号】(1)20mg:国药准字H201����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������93380 (2)40mg:国药准字H20����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������193381
【生产企业】
企业����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������名称:山东罗欣药业集团股份有限公����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������司
����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ������� 生产地址:山东省临沂高新技术产业开发区����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������罗七路
邮政编码:����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������276017
电话号码:����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������0539-8257899 ����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������; 8481991 &n����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������bsp; &n����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������bsp; ����� �������Ƴ����������� �������Ƴ������������ �������Ƴ����������� �������Ƴ������� &n����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������bsp; 传真号码:0539-����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������8481990
����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ������� 售后服务:0539-824269����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������9 &nbs����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ������p; &n����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������bsp; &����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������nbsp; &nbs����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������p; &nbs����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������p; &nbs����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������p; ����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������; 网&nb����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������sp; &nb����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������sp; 址:www.luo����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������xin.cn
【适应症】用于手术后疼痛的短期治疗。在决定使用����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������选择性环氧化酶-2(COX-2)抑制剂前����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������,应评估患者的整体风险。
【用法用量】推荐剂量为40mg静脉注射(I����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������V)或肌内注射(IM)给药,随����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������后视需要间隔6~12小时给����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������予20mg或40mg,每天总剂量不超8����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������0mg。由于选择性COX-2抑制����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������剂的心血管事件发生风险随着剂量及暴露时间增加����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ������而增加,因此,应尽可能使����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������用最短疗程及最低每日有效剂量。����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������使用本品超过三天的临床经验有限。����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������可直接进行快速静脉推注,或通过已有静脉����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������通路给药。肌内注射应选择深部肌肉缓慢推注。由����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������于本品与其它药物在溶液中混合可出现沉淀����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ������,因此不论在溶解或是注射过����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������程中,本品严禁与其它药物混合。如帕瑞昔布����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������与其它药物使用同一条静脉通路,帕瑞����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������昔布溶液注射前后须采用相容溶液充分冲洗静脉����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ������通路。
����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������与阿片类镇痛药联合用药:阿片类镇����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������痛药可以与帕瑞昔布同时应用,本品使用剂量参见����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������上文。在所有的临床评估中,帕瑞昔����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������布是固定间隔时间给药,而阿片类药物则是按需给药。����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������
老����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������年患者:通常,对于老年患者(≥65����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ������岁)不必进行剂量调整。但是,对于体����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������重低于50kg的老年患者,本品的初始剂量应减至常����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������规推荐剂量的一半且每日最高����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������剂量应减至40mg。
肝功����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������能损伤:目前尚无严重肝功����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������能损伤患者(Child-P����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������ugh 评分:≥10)的临床用����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������药经验,因此禁止在此类患者����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������中使用帕瑞昔布。通常,轻度肝功能损伤的����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������患者(Child-Pugh 评分:5~6)不必����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������进行剂量调整。中度肝功能损伤的患者(Chi����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������ld-Pugh 评分:7~9)应慎用����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������本品,剂量应减至常规推荐剂量的一半且每日最高剂量����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������降至40mg。
肾功能损伤:对于重����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������度肾功能损伤(肌酐清除率:<����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������30ml/min)或有液体潴留倾向的患����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������者,应选择最低推荐剂量(2����� �������Ƴ����������� �������Ƴ����������� �������Ƴ������������ �������Ƴ�������0mg)开始治疗并密切监测肾功能。依据帕瑞昔布����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������的药代动力学,不必对轻度至中度肾功能损����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������伤(肌酐清除率:30~80ml/min)的����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������患者进行剂量调整。
儿童用药:尚未����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������确定18岁以下儿童使用帕瑞昔布的安全和疗效。目����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������前尚无可用数据。因此,不����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������推荐在此类人群中使用帕瑞昔布。
使用与处置����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������(包括丢弃)指导说明 注射用帕����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������瑞昔布钠使用前必须重新配制。由于不含防����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������腐剂。因此要求采用无菌技术进行配制。����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������
配制溶����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������剂:可用于配制注射用帕瑞昔布钠的溶剂����� �������Ƴ����������� �������Ƴ����������� �������Ƴ������������ �������Ƴ�������包括:氯化钠溶液9mg/ml(0.9����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������%);葡萄糖注射液50mg/m����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������l(5%);氯化钠4.5mg/ml(0.����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������45%)葡萄糖50mg/ml(5%)注射液。
配制过程 采用无����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������菌技术配制帕瑞昔布冻干粉(����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������即帕瑞昔布)。去除启扣盖,暴露帕瑞����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������昔布玻璃瓶橡胶瓶塞的中央部分。用����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������无菌注射器及针头吸取适用溶剂(20mg帕瑞昔����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������布钠用1ml溶剂配制,40mg帕瑞昔����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������布钠用2ml溶剂配制),然后将针头插进橡胶瓶����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������塞中央向瓶内注入溶剂。轻轻旋转����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������瓶体使粉末完全溶解并在使����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ������用前仔细检查配制成的溶液。将瓶内全����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������部药液抽出供单次给药。配制后,����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������药液应为透明溶液。帕瑞昔布钠溶液应在使用前����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������进行目测,确定溶液是否有不溶性微����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������粒或发生变色。若观察到溶����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������液发生变色,出现絮状物或不溶性微粒,则不得����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������使用。配置后,帕瑞昔布钠溶液应在24小时内使����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������用,否则应废弃。已经证实在25����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������℃条件下,配制后药液(不得冷藏����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������或冷冻)的物理、化学稳定����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������性最长可保持24小时。因此,24小时应被视����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������为药物配制后的最长有效期。然而,由于����� �������Ƴ����������� �������Ƴ����������� �������Ƴ������������ �������Ƴ�������注射产品有微生物感染的重要风险,因此配制的溶����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������液应立即使用,除非溶液的配制是在严格控����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������制的、并经过验证的无菌环境中进行。除非满����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������足上述条件,否则使用者必须在使用前控����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������制其贮藏时间与条件。一般来说,在25℃����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������条件下保存不应超过12小����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������时。配制后的帕瑞昔布钠溶液为等渗����� �������Ƴ����������� �������Ƴ����������� �������Ƴ������������ �������Ƴ�������溶液。
静脉����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������通路溶液的相容性 采用适用溶液配制后����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������,帕瑞昔布钠溶液只能以静脉注射、肌肉注射、����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������或加入下列液体的静脉通路给药:����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������氯化钠注射液9mg/ml(0.9%) 葡萄糖����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������注射液50mg/ml(5%) ����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������氯化钠4.5mg/ml(0.45����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������%)和葡萄糖50mg/ml(5%) 注射液 乳酸����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������林格氏液 由于可以导致帕瑞����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������昔布在溶液中沉淀,故不推荐向含50m����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������g/ml(5%)葡萄糖的����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ������乳酸林格氏液或其它未列出溶液的静脉通����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������路中加入帕瑞昔布。配制后的药液仅供单次使用。任何����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������配制后未使用的医药产品或废����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������弃物品都应当按照当地要求����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ������予以处理。
药物的不相容性����� �������Ƴ����������� �������Ƴ����������� �������Ƴ������������ �������Ƴ������� 除[使用与处置(包括丢弃)指导说明]所列药物����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������外,帕瑞昔布不得与其它任何����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������药物混合。本品不应与阿片����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������类药物混和于同一注射器内给药。使用乳酸����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������林格氏液或含50mg/ml(5%)葡萄����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������糖的乳酸林格氏液配制,帕瑞昔布会在溶液中发生沉淀����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������,故不推荐使用。不推荐使用注射用水,因����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������为得到的溶液不等渗。帕瑞昔布钠溶液不应注入任����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ������何其它药物的静脉通路。帕瑞昔布钠溶液注����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������射前后应用相容溶液充分冲洗����� �������Ƴ������������ �������Ƴ����������� �������Ƴ����������� �������Ƴ�������静脉通路。由于可以导致帕瑞昔����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������布在溶液中沉淀,故不推荐向含50����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������mg/ml(5%)葡萄糖的乳酸林格氏液或����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������其他[使用与处置(包括丢弃)的指导]中未列出����� �������Ƴ����������� �������Ƴ����������� �������Ƴ����������� �������Ƴ�������溶液的静脉通路中加入帕瑞昔����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������布。