山东罗欣药业集团股份有限公司招标公告
【规 &nb����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������sp; 格】50ml:12.5mg(����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������以C22H36N2O5S计)
【包 &nbs����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ������p; 装】钠钙玻璃输液瓶,1瓶����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������/盒
【单 &nbs����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������p; 位】瓶
【批准文号】国药准字H20183527
【药品名称】
通用名称: 盐酸替罗非班注射用浓溶液
英文名称: Tirofiban Hydroc����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������hloride Concentrated����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ������� Solution for In����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ������jection
汉语拼音: Yansuan Tiluofeiban����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������� Zhusheyong Nongrongy����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������e
【成 &n����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������bsp; 份】
本品主成份为盐酸替罗非班,
化学名称:N-(丁基磺酰基)-氧-[4-(4-哌啶基)丁基]-L-酪氨酸盐酸盐一水合物,
化学结构式:
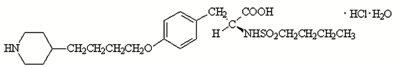
分子式:C22H36N2O5S·HCL·H2O
分子量:495.08
辅料:醋酸钠、氯化钠、酒����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������石酸、注射用水
【性 状】
本品为无色的澄明液体
本品治疗开始和持续时间
对于采用早期介入治疗策略且不准备在诊断后����� �������Ƴ����������� �������Ƴ����������� �������Ƴ������������ �������Ƴ�������4~48小时内进行血管造影术的NSTE-ACS患者,应在确定诊断后开始本品0.4μg/kg/min负荷剂量给药方案,建议的����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������维持输注持续时间应至少为48小时。冠状动脉血管造影术����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������期间可继续输注本品和普通肝素����� �������Ƴ����������� �������Ƴ������������ �������Ƴ����������� �������Ƴ�������,在血管成形术/经皮腔内斑块旋切术后应维持至少12小时,且不超过24小时。一旦患者临床表现稳定并且主治医生没有计����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������划进行任何冠状动脉介入手术,应停止输注。整个治����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������疗时间不超过108小时。如果NSTE-ACS患者在诊断后4小时内进行介入治疗,应在PCI开始时给予本品25μg/kg剂量静脉推注方案,输液应持续12-24小时,最长可达48小时。对计划进行直接PCI的急性心肌梗死患者,应在诊断后尽快����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������开始25μg/kg剂量推注方案。
合并治疗(普通肝素、口服抗血小板治疗,����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������包括阿司匹林):
采用普通肝素的治疗应以50~60U/kg静脉推注开始,然后以1,000U/h剂量维持输注。调整肝素剂量,以维持APTT约为正常值的2倍。
除非禁忌,否则在本品治疗����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������开始之前,所有患者应接受口����� �������Ƴ����������� �������Ƴ����������� �������Ƴ������������ �������Ƴ�������服抗血小板药物,包括但不限于����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������阿司匹林。应至少在本品输����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������注期间持续这种治疗。
如果需要进行血管成形术(PCI),那么在PCI后应停用肝素;一旦凝血功能恢复����� �������Ƴ����������� �������Ƴ����������� �������Ƴ������������ �������Ƴ�������正常,例如,当激活凝血时间(ACT)小于180秒时(通常在停用肝素后2~6小时),应撤去鞘管。
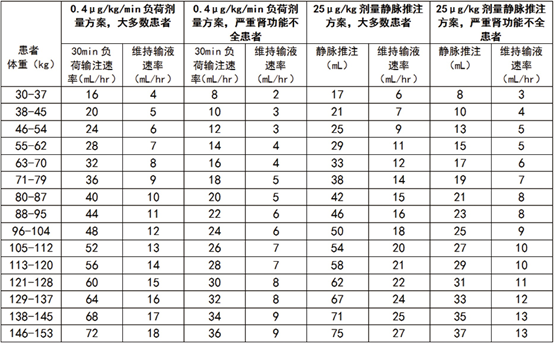
严重肾功能不全患者:如上����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������面调整剂量表所特别指出的,对于严重肾����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������功能不全的患者(肌酐清除率小于����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������30ml/min),本品的剂量应减少50%(参见注意事项,严重肾功能不全,药代动����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������力学,患者的特点,肾功能不全)。
其他患者:对于老年患者(参见老年用药)或女性患者����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������不推荐调整剂量。
使用说明
如果溶液和容器允许的话,胃肠道外药����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������品在使用之前应肉眼检查颗粒及变色。
盐酸替罗非班注射用浓溶液使用前必须稀����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������释(参见由盐酸替罗非班注����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������射用浓溶液配制输注溶液的说����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������明)。
由盐酸替罗非班注射用浓溶液配制输注溶����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������液的说明
1.从一袋250ml的无菌生理盐水或5%的葡萄糖溶液中抽出50ml,然后在剩余200ml溶液中注入50ml的本品(从一个50ml小瓶中抽取),得到的浓度为50μg/ml。在使用前要充分混匀。
2.根据上述按体重调整的适当剂量����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������给药。
3.任何尚未使用的静脉溶液都����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������须丢弃。
本品可以与下列注射药物在同一条静脉输����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������注线中使用,如硫酸阿托品、多巴酚丁胺、����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������多巴胺、盐酸肾上腺素、呋塞米、利多卡因,盐酸咪达����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������唑仑、硫酸吗啡、硝酸甘油、氯化钾、盐酸普萘����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������洛尔、及法莫替丁。但是,本品不能与地西����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������泮在同一条静脉输液线中使用。
【不良反应】
a.安全性总结
当与肝素、阿司匹林和其它口服抗血小����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������板药联用时,替罗非班治疗期间报告的最常见不良反应����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������是出血,通常涉及轻度皮肤粘膜出����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������血或轻度导管插入部位出血����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������。
胃肠道、腹膜后、颅内、痔和����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������术后出血,脊柱区硬膜外血肿,心外膜和肺(����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������肺泡)出血也有报道。在关键性替罗非����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������班研究中,TIMI严重出血和颅内出血的发生率分别����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������为≤2.2%和<0.1%。最严重的不良反应是致死����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������性出血。
在关键性研究中,替罗非班给药与血小板减少症(����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������血小板计数<90,000/mm3)有关;在替罗非班和肝素联合治疗患����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������者中血小板减少症的发生率为1.5%,其中严重血小板减少症(血小板计数<50,000/mm����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������3)的发生率为0.3%。与肝素联用时,与替罗非班有关的最常见非出血性药����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������物不良反应为恶心(1.7%)、发热(1.5%)和头痛(1.1%)。
b. ����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������� 不良反应总结表
下表中列出了基于六项双盲对照临床����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������研究(包括接受替罗非班联合肝素����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������治疗的1953名患者)的不良反应以及上市后经验����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������报告的不良反应。在器官系统分类下,按照����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������发生频率的不同,将不良反应分为以下几类����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������:非常常见(>1/10)、常见(≥1/100 - <1/10)、不常见(≥1/1,000 - <1/100)、罕见(≥1/10,000 - <1/1,000)、非常罕见(<1/10,000)和不明(无法根据已有数据估算)。由于上����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������市后事件来自不确定大小的群体的自����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������发报告,所以无法确定它们的确切����� �������Ƴ����������� �������Ƴ����������� �������Ƴ������������ �������Ƴ�������发生频率。因此,这些不良反应的发生率����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������分类为不明。
在临床研究和上市后经验中的不良反应
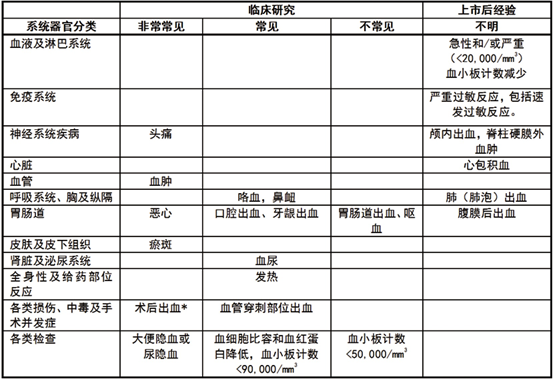
*主要与导管插入部位相关。
c. &nbs����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������p; &n����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������bsp; 特定不良反应的描述
出血
当采用0.4μg/kg/min输注方案和25μg/kg剂量推注方案,严重出血并发症����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������的发生率较低且没有显著性升����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������高。
在PRISM-PLUS研究中,使用替罗非班0.4μg/kg/min输注方案,替罗非班与肝素联合治疗的����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������TIMI标准严重出血的发生率为1.4%,单独肝素治疗的发生率为0.8%。替罗非班与肝素联合治疗时,TIMI轻度出血的发生率为10.5%,单独肝素治疗的发生率为8.0%。替罗非班与肝素联合使用的患者中,接����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������受输血的百分比为4.0%,单独使用肝素的百分比为2.8%。
从ADVANCE研究获得的数据表明,出血事件的数量少,且与安����� �������Ƴ����������� �������Ƴ����������� �������Ƴ������������ �������Ƴ�������慰剂比较似乎没有显著性升高����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������。两组均无TIMI严重出血,无输血。使用替罗非班25μg/kg剂量方案的TIMI轻度出血为4%,对比在安慰剂组的发生率为1%(p=0.19)。
在On-Time 2研究中,在替罗非班25μg/kg剂量推注方案组和对照组之����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������间,TIMI严重出血的发生率(3.4%对比2.9%,p=0.58)和TIMI轻度出血的发生率(5.9%对比4.4%,p=0.206)没有显著性差异。
在MULTISTRATEGY研究中,替罗非班25μg/kg剂量方案与标准剂量阿昔单抗方案进行比较����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������,TIMI严重出血的发生率(2.4%对比1.6%,p=0.44)或轻度出血的发生率(4.8%对比6.2%,p=0.4)没有显著性差异。
基于一项荟萃分析中对出血性并发症����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������的评估(4076名ACS患者),与安慰剂相比,替罗非班25μg/kg剂量推注方案没有显著增加严重出血或血����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ������小板减少的发生率。在替罗非班25μg/kg推注方案与阿昔单抗对比的试验中,����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������单个试验的研究结果未显示两种治疗����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������之间的严重出血有显著性差异。
血小板减少症
在II期和III期临床研究中,与单用肝素����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������治疗的对照组相比,替罗非班与肝素联合治疗组趋����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������向于更易发生血小板计数下降����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������。当停用替罗非班后,这些下降是可逆����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������的。在没有既往血小板减少症史的患者����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������中,重新给予GP IIb/IIIa受体拮抗药时也可能观察到血小����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������板减少,且可能伴随寒战、低热或出血并发症。
对比25μg/kg剂量推注方案与阿昔单抗的研究分析,结果显示替罗非����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������班的血小板减少的发生率明显更����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������低(0.45%对比1.7%;OR=0.31;p=0.004)。
过敏反应
在替罗非班初始治疗(也在����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������第一天)和再次给药过程中,均可能����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������发生严重过敏反应(如支气管痉挛、荨麻疹),包����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������括速发过敏反应。一些病例����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������还伴随严重血小板减少(血小板计数<10,000/mm3)。
实验室化验结果
接受本品与肝素联合治疗的患者最常见的实验室不良事����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������件与出血相关。发现有血红蛋白、红细胞压积和血小板����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������计数下降。也可见尿和大便隐血增加。
【禁 忌】
本品禁用于对其任何成份过敏的患者����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������。也禁用于那些以前使用本品出现血小板减少����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������的患者。
由于抑制血小板聚集可增加出血的危险,����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������所以本品禁用于具有下述情况的患者:
·在30天内卒中史或任何出血性卒中����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������史。
·已知的颅内疾病史(如肿瘤、动静脉畸形����� �������Ƴ����������� �������Ƴ����������� �������Ƴ������������ �������Ƴ�������、动脉瘤)。
·活动性或近期(在治疗之前30天内)临床相关出血史(如胃肠道出血)����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������。
·恶性高血压。
·在过去6周中相关创伤或重大外科手术干����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������预。
·血小板减少症(血小板计数<100,000/mm3)、血小板功能障碍。
·凝血障碍(如凝血酶原时间>1.3倍正常值或INR [国际标准化比值]>1.5)。
·重度肝衰竭。
【注意事项】
不推荐替罗非班单独给药。
关于替罗非班与依诺肝素联用的经验有限����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������。替罗非班联合依诺肝素的疗效尚未确立。尚未����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������确定替罗非班与其它低分子量肝����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������素使用的安全性和疗效。
在下述疾病和状况下使用盐酸替罗非班的经验不����� �������Ƴ������������ �������Ƴ����������� �������Ƴ����������� �������Ƴ�������足;但是,怀疑会增加出血的风险。因����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������此,盐酸替罗非班不推荐用于:
·在过去两周内进行过创伤性或长时间心肺复����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������苏、器官活检或碎石术
·既往重度创伤或大手术>6周但<3个月
·在过去3个月内活动性胃溃疡
·未控制的高血压(>180/110mmHg)
·急性心包炎
·活动性血管炎或已知血管炎病����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������史
·怀疑主动脉夹层形成
·出血性视网膜病
·大便隐血或血尿
·溶栓治疗
·一定程度上增加出血风险的����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������合并用药。
在下述情况和患者群中,替罗非����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������班应谨慎使用:
·近期发生临床相关的出血(小于����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������1年)
·在替罗非班给药之前24小时内进行过不可压迫性血管穿刺����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������
·近期进行过硬膜外手术(包括����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������腰穿和脊髓麻醉)
·重度急性或慢性心力衰竭
·心源性休克
·轻度至中度肝功能不全
·血小板计数<150,000/mm3,已知的凝血障碍、血小板功能障碍或血小板减����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������少病史
·血红蛋白浓度小于11g/dL或血细胞比容<34%
·合并使用噻氯匹啶、氯吡格雷、����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������腺苷、双嘧达莫、磺吡酮以及前列环素
出血的预防
因为替罗非班抑制血小板聚集,所����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������以与其它影响止血的药物合用时应当谨慎。本品与溶栓����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������药物联用的安全性尚未确定,因此,不建议本����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������品与溶栓药合并使用。
如果出现需要紧急冠脉旁路移植术����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������(CABG)或需要主动脉内球囊反搏术����� �������Ƴ������������ �������Ƴ����������� �������Ƴ����������� �������Ƴ�������的情况,应立即停用。
本品治疗期间,应监测病人有无潜在的出血。当出血����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������需要治疗时,应考虑停止使用本品。也要考虑����� �������Ƴ����������� �������Ƴ������������ �������Ƴ����������� �������Ƴ�������是否需要输血。
曾有报导发生致命性出血(见不良反应)。����� �������Ƴ����������� �������Ƴ����������� �������Ƴ������������ �������Ƴ�������
股动脉穿刺部位:本品可轻����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������度增加出血的发生率,特别是在����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������股动脉鞘管穿刺部位。当要进行血����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������管穿刺时要注意确保只穿透股动脉的前壁。鞘管拔出后����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������要注意正确止血并密切观察。
实验室监测:在本品治疗前、推注或负荷输注后6小时内以及治疗期间至少每天要监测血小板����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������计数、血红蛋白和血球压积(如果证实有显著下降需����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������更频繁)。在原先接受过血小板糖蛋白IIb/IIIa受体拮抗剂的病人应当考虑����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������尽早监测血小板计数。如果病����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������人的血小板计数下降到小于90000/mm3,则需要复查血小板计数以排除假性血小板减少。如果����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������已证实有血小板减少,则须停����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������用本品和肝素,并进行适当监测和治疗����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������。
此外,在治疗前后应测定活化部分����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������凝血酶原时间(APTT),并且应当反复测定APTT以密切监测肝素的抗凝效应并据此调整����� �������Ƴ����������� �������Ƴ����������� �������Ƴ������������ �������Ƴ�������剂量(见用法用量)。有可能发����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ������生潜在致命性出血,特别是肝����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������素与影响止血的其它产品如血小板糖蛋白IIb/IIIa受体拮抗剂联用时尤其可能。
严重肾功能不全
在临床研究中,已证明有严重肾����� �������Ƴ������������ �������Ƴ����������� �������Ƴ����������� �������Ƴ�������功能不全(肌酐清除率小于30ml/min)的患者其替罗非班血浆清除����� �������Ƴ����������� �������Ƴ������������ �������Ƴ����������� �������Ƴ�������率下降。对于这样的病人应减少50%的剂量(参见用法用量)。临床研究证据表明����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������,随着肌酐清除率下降,替罗非班的血浆清除率也相����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������应降低,出血风险有升高趋势。因此����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������,对肾功能减低(肌酐清除率<60 mL/min����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������)患者在治疗期间应仔细监测出血事件以及肝素效应����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������。
【孕妇及哺乳期妇女用药】����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������
本品尚未在妊娠妇女中进行适当且对照����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������良好的研究。在妊娠期间,本品只可用于已证����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������明对胎儿潜在的益处大于潜在的危险时。
在大鼠中,替罗非班可泌入����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������乳汁。尚不知替罗非班是否从����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������人的乳汁排泌。因许多药物可����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������以排泌到人乳汁中,而且可能对哺乳的婴儿����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������产生不良反应,所以要根据此药对母亲的重要性来����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������决定是中断哺乳还是中断药物治疗。
【儿童用药】
年龄小于18岁儿童用药的安全性和有效性尚����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������未确定,因此,不建议在该人群中使用。����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������
【老年用药】
在临床研究中,替罗非班对老年病����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������人(≥65岁)的有效性与对年轻病人����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������(<65岁)的相似。老年病人接受本品和肝素联合治疗或者肝����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������素单独治疗比年轻病人有较高的出血发生率。不����� �������Ƴ����������� �������Ƴ������������ �������Ƴ����������� �������Ƴ�������考虑年龄因素,接受本品与肝素联用治疗的患者与单����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������独应用肝素的患者相比其出血危险性的增加相似。����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������非出血性不良事件的总发生率����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������在老年患者要高一些(与年轻患者相比);但在老年����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������患者中,本品与肝素联合治疗和肝素单独治疗����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������相比,非出血性不良事件的发生����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������率相似。不需要调整剂量(����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������参见用法用量,其他病人)。
【女性患者和低体重患者】
女性患者出血并发症发生率高于男性患者。低体重患者����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������出血发生率高于高体重患者。因此,在这些患者中����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������使用本品应谨慎,并仔细监测肝素效����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������应(参见用法用量,其他患者)。
【药物相互作用】
已对替罗非班与阿司匹林和肝素的相互作用已����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������进行了研究。
本品与肝素和阿司匹林联用����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������时,比单独使用肝素和阿司匹林出血的发����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������生率增加(参见不良反应)。当本品与其它影响����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������止血的药物(如华法令)合用时应谨慎(参����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������见注意事项,出血的预防)。
因可能增加出血风险,在溶栓治疗中不推����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������荐给予本品(与溶栓治疗合用����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������或溶栓治疗后48小时内)。不建议本品与口服抗凝药、其他����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������血小板GPⅡb/Ⅲa抑制剂及葡聚糖溶液等明确增加出血风险的药物合����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������并使用。
在临床研究中本品已与β-阻滞剂、钙拮抗剂、非甾体类抗炎药����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������(NSAIDS)及硝酸酯类联用,未见有����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������临床意义的不良相互作用。
在PRISM研究(血小板受体抑制对缺血综合征的治疗)一个亚组����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������的病人(n=762)中,接受下列药物之一的患者的替罗非班血浆清除率����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������与未接受这些药物的患者的血浆清除率相似����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������。这些药物对替罗非班的血浆清除率没有具临床意����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������义的相互作用。这些药物是:醋丁洛尔、醋����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������氨酚、阿普唑仑、氨氯地平、阿司匹����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������林、阿替洛尔、溴西泮、卡托普利、地西泮、����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������地高辛、地尔硫卓、多库酯钠、依那普利、呋塞米、����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������优降糖、肝素、胰岛素、异山梨酯、左旋甲状腺素、劳����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������拉西泮、洛伐他汀、甲氧氯普胺、美托洛尔、吗啡、硝����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������苯地平、硝酸酯类、奥美拉����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������唑、奥沙西泮、氯化钾、普萘洛尔、雷尼替丁、����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������辛伐他汀、硫糖铝和替马西泮。
【药物过量】
在临床研究过程中,曾由于����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������疏忽发生盐酸替罗非班用药过量,最高达����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������50μg/kg(三分钟推注)或1.2μg/kg/min(初始输注)。也发生过高达1.47μg/kg/min(维持输注速率)的用药过量。
a) 用药过量的症状
用药过量的症状最常见报告为出血,通常是在����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������心导管插入术中动脉穿刺位点的粘膜出血和局部����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������出血,但也有颅内出血和腹膜后出血的单独病例����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������报道。
b) 措施
盐酸替罗非班用药过量,应根据患者的����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������状况和经治医生的评估进行处理。如����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������果需要治疗出血,应停止替罗非班输����� �������Ƴ����������� �������Ƴ����������� �������Ƴ������������ �������Ƴ�������注。还应该考虑血液和/或血小板的输注。替罗非班可通过����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������血液透析清除。
【临床试验】
不稳定心绞痛/无Q波心肌梗死
在这项多中心、随机、平行分组、双盲的PRISM PLUS(血小板受体抑制来控制缺血性症状-患者受����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������限于不稳定的体征和症状)试����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ������验中,针对有病史记录的不稳定心绞痛/无Q波心肌梗死患者,评价比较了AGGRASTAT联合肝素与肝素单用。在这项试验����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������中,患者随机化后要么接受AGGRASTAT(先给予负荷量0.4μg/kg/分输注30分钟,随后给予维持量0.10μg/kg/分)和肝素(快速推注5000单位(U),随后以1000 U/小时的给药速度静滴,维持活化部分����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������凝血激酶时间(APTT)大约为对照组的2倍),要么接受肝素单用(快速推注5000单位(U),随后以1000 U/小时的给药速度静滴,维持APTT大约为对照组的2倍)。除非禁忌,否则所有����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������患者伴随使用阿司匹林。AGGRASTAT治疗开始于最近一次胸痛发作后12小时内。患者接受48小时的试验药物治疗使病情稳定,随后如果有指����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������征可接受血管造影和血管成形����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������术/经皮腔内斑块旋切术,同时继续接受����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������AGGRASTAT治疗。AGGRASTAT的给药时间通常最小为48小时,而且可以持续给药至108小时;平均来说,患者接受AGGRASTAT的给药时间为71.3小时。第3组患者接受了AGGRASTAT单用治疗[参见下面的PRISM试验(血小板受体抑制来控制缺����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������血性症状)描述]。
该试验的主要终点是下列方面的����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������综合:顽固性缺血、新发心肌梗塞����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������和AGGRASTAT给药7天时的死亡情况。在主要终点方面,总体综合指数����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ������的风险降低31.6%,心肌梗塞的风险降低46.6%,心肌梗塞和死亡的综合风险����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������降低42.8%。结果见表1。
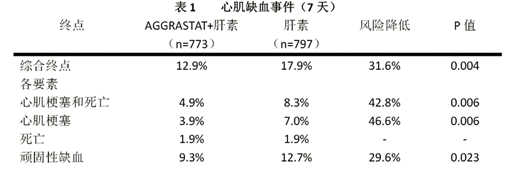
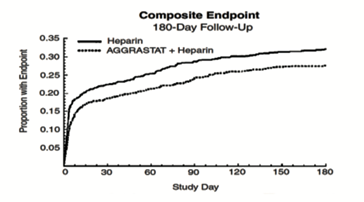
早期的临床收益维持至30天,而对于大部分各要素来说����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ������则维持至6个月。在30天时,综合终点的风险降低了21.8%;另外,死亡和心肌梗塞综合后的风险降低了����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������29.8%。在6个月时,综合终点的风险降低了18.9%;而死亡和心肌梗塞综合后的风����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������险降低了22.5%。综合终点在7天、30天和6个月时的风险降低情况参见下面的Kaplan-Meier曲线。
在PRISM PLUS试验中接受血管成形术/经皮腔内斑块旋切术的30%患者中,试验药物开始治疗30天时的术后综合终点风险降低45.7%,死亡和心肌梗塞综合后的风险降低43.2%。
PRISM PLUS中的亚组试验结果表明,与肝素单用相比,AGGRASTAT联合肝素治疗患者中血管造影显示的血����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������栓程度显著降低。另外,受累冠脉的血流量����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������显著改善。
在PRISM PLUS试验中,无论年龄和性别如何,����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������AGGRASTAT所带来的收益是一致的。
在随机、平行分组、双盲的PRISM试验中,已经在不稳定心绞痛/无Q波心肌梗死患者中比较了AGGRASTAT单用(n=1616)与肝素单用。在AGGRASTAT输液48小时后的主要综合终点(顽����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������固性缺血、心肌梗塞或死亡)风险����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������明显降低。在30天时,综合终点结果与应用肝素时的观察结果相似;但����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������是与肝素相比,死亡发生率显著降低。在PRISM PLUS试验中,由于7天时的死亡率升高,所以数据安全性监测委����� �������Ƴ����������� �������Ƴ����������� �������Ƴ������������ �������Ƴ�������员会在期中分析时将AGGRASTAT单用组(n=345)结束。但是,这两项试验(PRISM和PRISM PLUS)的数据合并分析结果表明,����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������AGGRASTAT单用对死亡率(7和30天时)的影响与肝素单用的影响相似。
经皮冠脉介入治疗(PCI)
ADVANCE研究在进行择期或紧急PCI的患者中确定了AGGRASTAT 25μg/kg剂量推注方案与安慰剂比较的安全性和有����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������效性,这些患者表现出高风险特征,包括至少����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������有一段冠状动脉狭窄≥70%和糖尿病,需要多血管干预或NSTE-ACS。所有患者接受普通肝素、阿司匹林和噻吩并吡啶负荷����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������剂量,随后接受维持治疗。总共202例患者被随机分配至AGGRASTAT组(25μg/kg静脉推注、在3分钟内完成,随后连续静脉输注0.15μg/kg/min、持续24~48小时)或安慰剂组,在PCI之前立即给药。
主要终点为手术后180天的中位随访期内,死亡、非致死性MI、紧急靶血管重建术(uTVR)或血栓形成挽救GP IIb/IIIa抑制药治疗的复合终点。
在意向治疗人群中,安慰剂组和AGGRASTAT组主要终点的累积发生率分别为35%和20%(危险比(HR) 为0.51 [95%置信区间(CI)为0.29至0.88];p=0.01)。与安慰剂相比,在AGGRASTAT组中,死亡、MI或uTVR的复合终点显著减少(31%对比20%,HR为0.57,95%CI为0.99-0.33);p=0.048。
EVEREST试验是一项随机化、开放标签试����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������验,比较在冠状动脉监护病房中开始的上游0.4μg/kg/min负荷剂量方案与在PCI之前10分钟开始的AGGRASTAT 25μg/kg剂量推注方案或阿昔单抗0.25mg/kg方案。所有患者另外还接受阿司匹林和噻吩并吡啶。����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������93例入组试验的NSTE-ACS患者在入院24~48小时内视情况而定进行血管造影����� �������Ƴ������������ �������Ƴ����������� �������Ƴ����������� �������Ƴ�������和PCI。
关于组织水平灌注和肌钙蛋白I释放的主要终点,EVEREST的结果确定PCI后TIMI心肌灌注分级(TMPG) 0/1的发生率显著降低(分别是����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������6.2%、20%和35.5%;p=0.015)和PCI后MCE评分指数显著改善(分别为0.88±0.18、0.77±0.32与0.71±0.30;p<0.05)。
在使用上游AGGRASTAT方案治疗的患者中,与PCI 25μg/kg剂量推注AGGRASTAT或阿昔单抗进行比较,术后心肌肌钙蛋白I (cTnI)升高的发生率显著降低(分别为9.4%、30%和38.7%;p=0.018)。与PCI AGGRASTAT(3.8±4.1与7.2±12;p=0.015)和阿昔单抗(3.8±4.1与9±13.8;p=0.0002)相比,AGGRASTAT上游方案的PCI后的cTnI水平也显著降低 。PCI AGGRASTAT����� �������Ƴ����������� �������Ƴ����������� �������Ƴ������������ �������Ƴ������� 25μg/kg剂量推注和阿昔单抗方案之间的比较表明,����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������PCI后TMPG 0/1的发生率没有显著性差异(20%对比35%;p=非显著性)。
ON-TIME 2试验是一个多中心、前瞻性、随机化、����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������对照临床试验,目的是在计����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������划进行直接PCI的STEMI患者中,评估早期25μg/kg剂量推注AGGRASTAT方案的作用。所有患者均接受阿司匹林、氯����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������吡格雷600mg负荷剂量和普通肝素。根据预定的标����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������准,允许使用AGGRASTAT挽救方案。该研究在两个阶����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������段完成:一个先导的开放标签阶段(n=414),随后是更大的双盲阶段����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������(n=984)。预定的、两个阶段数据的汇总分析,用于评价常����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������规25μg/kg剂量推注方案与对照组相比的作用,����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������通过定义30天的主要心血管不良事件(MACE)率为主要终点(死亡、复发性MI和uTVR)来考察。
在该汇总分析中,与对照组相比,AGGRASTAT的早期启用显著性降低30天的MACE(5.8%与8.6%;p = 0.043)。此外,AGGRASTAT组全因死亡的死亡率有显著性降低的����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ������趋势(AGGRASTAT组2.2%,对照组4.1%;p=0.051)。这种死亡率的获益主要是由于心源性死亡的减����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������少(2.1%对比3.6%;p=0.086)。在1年随访(次要终点)时,死亡率差异保����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������持不变(全因死亡率,3.7%对比5.8%,p=0.078;心源性死亡率,2.5%对比4.4%;p=0.061)。
在进行直接PCI的患者(汇总分析研究人群的86%)中,30天(AGGRASTAT组中为1.0%,对照组中为3.9%;p=0.001)和1年(AGGRASTAT组中为2.4%,对照组为5.5%;p=0.007)时AGGRASTAT组的死亡率均显著降低。
MULTISTRATEGY研究是一项开放标签、2X2因子、跨国试验,在STEMI患者中,比较当与西罗莫司洗脱(SES)支架或裸金属支架(BMS)一起使用时AGGRASTAT(n=372)与阿昔单抗(n=372)的疗效。在血管造影术过程中,在动脉鞘管插����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������入之前给予AGGRASTAT(推注25μg/kg,随后以0.15μg/kg/min持续输注18至24小时)或阿昔单抗(推注0.25mg/kg,随后以0.125μg/kg/min输注12小时)。所有患者均接受普通肝素、阿司匹林����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������和氯吡格雷。
药物比较的主要终点是累积ST段回落,表示为在最后一次球囊����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������充气后90分钟内实现至少50%恢复的患者比例,并以该终点检验AGGRASTAT不劣于阿昔单抗的假设。
在意向治疗人群中,ST段抬高恢复至少50%的患者百分比在AGGRASTAT(85.3%)和阿昔单抗(83.6%)之间没有显著性差异,证实����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������了AGGRASTAT相对于阿昔单抗的非劣效性 (AGGRASTAT比阿昔单抗的RR为1.020;97.5%CI为0.958-1.086;非劣性p<0.001)。
在30天时,阿昔单抗和AGGRASTAT的MACE发生率相似(分别为4.3%和4.0%;p=0.85);在8个月时,这些结果维持不变(����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������分别为12.4%和9.9%;p=0.30)。
一项荟萃分析评估了AGGRASTAT 25μg/kg剂量推注方案与阿昔单抗的疗效����� �������Ƴ������������ �������Ƴ����������� �������Ƴ����������� �������Ƴ�������(包括2213例ACS患者,ACS患者中包含NSTEMI和STEMI患者),结果表明,30天时,在两种药物之间死亡或MI的比值比(OR)没有任何显著性差异(OR为0.87 [0.56-1.35];p=0.54)。同样地,在AGGRASTAT和阿昔单抗之间,30天死亡率没有显著性差异(OR为0.73 [0.36-1.47];p=0.38)。此外,在最长时间随访时,在AGGRASTAT和阿昔单抗之间,死亡或MI的发生率没有显著性差异(OR为0.84 [0.59-1.21]����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ������;p=0.35)。
在TARGET研究中,采用替罗非班10μg/kg静脉推注、随后以0.15μg/kg/min剂量输注,替罗非班未达到相对于阿昔单抗的非劣效性����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������:复合主要终点(在30天时死亡、MI或uTVR)的发生率表明,阿昔单抗����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������在临床相关性终点上更有效����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������,替罗非班组为7.6%、阿昔单抗组为6.0% (p=0.038),这主要是由于在30天时MI发生率显著升高引起的(分别为6.9%对比5.4%;p=0.04)。
【药理毒理】
药理作用
替罗非班是纤维蛋白原与GPIIb/IIIa受体结合的可逆性拮抗药;这种受体是涉及血小板����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������聚集的主要血小板表面受体。当静脉给药����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������时,替罗非班剂量和浓度依赖性����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������抑制离体血小板聚集。
毒理研究
遗传毒性:
替罗非班体外微生物突变试验����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������、V-79哺乳细胞突变试验结果为阴性。体外碱洗脱和体����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������外染色体畸变试验未见直接遗����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������传毒性。雄性小鼠静脉给予替罗����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ������非班剂量达5mg/kg(按体表面积进行比较时,约为人类每日最大推荐����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������剂量的3倍),未见诱导骨髓细胞染色体畸变。
生殖毒性:
雄性大鼠和雌性大鼠静脉注射给予替罗非����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������班剂量达5mg/kg/日(按体表面积进行比较时,约����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������为人类每日最大推荐剂量的5倍),未见对生育力和生殖功能����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ������的明显影响。
妊娠大鼠和妊娠兔静脉注射替罗非班剂量达5mg/kg/天(按体表面积进行比较时,分����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������别为每日推荐最大人类剂量的5倍和13倍),未见对胎仔生长发育的明显影响,����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������替罗非班能透过胎盘。在大鼠乳汁中有较高分����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������布。
【药代动力学】
在0.01~25μg/ml的浓度范围内,替罗非班与血浆蛋白结合����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������率呈浓度非依赖性。人体血浆中不结合部分为����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������35%。替罗非班的稳态分布容积范围为22~42升。替罗非班可以通过大鼠及兔的胎盘。����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������
分析以14C标记替罗非班在尿液及粪便����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������中的代谢产物情况,表明其放����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������射性主要来自原型替罗非班,循环血����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������浆放射性主要来自原型替罗非班(用药后达10小时)。这些资料提示替罗非����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������班的代谢有限。
在健康人中以14C标记替罗非班给一次静脉剂量����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������后,66%的放射性在尿液中回收,23%的放射活性在粪便中回收。放射����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������活性的总回收率为91%。替罗非班主要经肾和胆汁排泄。����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������
在健康人中替罗非班血浆清����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������除率范围从213至314ml/min。肾脏清除率占血浆清除率的39%至69%,半衰期范围从1.4至1.8小时。
在冠心病病人中替罗非班血浆清除率范围从����� �������Ƴ����������� �������Ƴ����������� �������Ƴ������������ �������Ƴ�������152至267ml/min。肾脏清除率占血浆清除率的39%,半衰期范围从1.9至2.2小时。
患者的特点:
性 别:冠心病病人中替罗非班的血浆清除����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������率男女相似。
老年人:年龄>65岁的老年冠心病病人比≤65岁较年轻病人的替罗非班血浆清除����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������率约低19~26%。
种 族:不同种族病人未见血浆清除率有差异。
冠状动脉疾病:在不稳定型心绞痛或NQWMI患者中,血浆清除率约200mL/min,肾清除率约为血浆清除率的39%。半衰期约为2小时。
肝功能不全:在轻中度肝功能����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ������不全病人中,替罗非班的血浆清除率与健����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������康人没有明显差别。
肾功能不全:临床研究数据显����� �������Ƴ����������� �������Ƴ������������ �������Ƴ����������� �������Ƴ������示,替罗非班在肾功能减退����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������患者中的血浆清除率降低,依赖于肌酐����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������清除率的损害程度。在肌酐清除率小于30mL/min的患者(包括血液透析患者����� �������Ƴ����������� �������Ƴ����������� �������Ƴ������������ �������Ƴ�������)中,替罗非班的血浆清除率降低至临床相����� �������Ƴ����������� �������Ƴ������������ �������Ƴ����������� �������Ƴ�������关程度(超过50%)。替罗非班可经血液透析清除。����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������
【贮 藏】遮光,密闭(15~30℃)保存。
【包 &nb����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������sp; 装】钠钙玻璃输液瓶,1瓶/盒。
【有 效 期】 24个月。
【执行标准】YBH03812018
【批准文号】国药准字H20183527
【生产企业】
企业名称:山东裕欣药业有限公司
生产地址:临沂市罗庄区罗七路中段西侧
邮政编码:276017
电话号码:0539-8257899&n����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������bsp; 8481991
传真号码:0539-8481990
售后服务:0539-8242699
用于末次胸痛发作12小时之内且伴有ECG改变和/或心肌酶升高的非ST段抬高型急性冠脉综合征(NSTE-ACS)成年患者,预防早期心肌梗死。最可能受益的患者是����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������在急性心绞痛症状发作后头3-4天内具有较高心肌梗死风险的患者,包括可能进行早����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������期经皮冠状动脉介入术(PCI)的患者。
用于计划进行直接PCI的急性心肌梗死患者(STEMI),以减少重大心血管事件����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������的发生。
本品应与普通肝素和阿司匹林一起使用。
盐酸替罗非班注射用浓溶液使用前����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������必须稀释(参见使用说明)。
本品仅供静脉使用,需用无菌设备����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ������。本品可与普通肝素联用,从同一液路输入。����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������
建议用有刻度的输液器输入本����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������品。必须注意避免长时间负荷输����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������入。还应注意根据患者体重计算静����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������脉推注剂量和滴注速率。
临床研究中的患者除有禁忌症外,均����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������服用了阿司匹林。
非ST段抬高型急性冠脉综合征(NSTE-ACS):
对于采用早期介入治疗策略且不准备在诊断����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������后4~48小时内进行血管造影术的患者,首先给予本品����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������0.4μg/kg/min静脉输注30分钟,继以0.1μg/kg/min的速率持续静脉滴注。本品应与普通����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������肝素和口服抗血小板治疗药物一起����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������给药,口服抗血小板药物包括但不限于阿司匹����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������林,除非禁忌。
经皮冠脉介入术(PCI):
对于计划在诊断后4小时内进行PCI的NSTE-ACS患者或计划进行直接PCI的ST段抬高型急性心肌梗死患者(STEMI),应先给予本品25μg/kg快速静脉推注,在3分钟内完成,继以0.15μg/kg/min的速率维持静脉滴注12~24小时,最长可达48小时。本品应与普通肝素和口服抗血小����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������板治疗药物(包括但不限于阿����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������司匹林,除非禁忌)合用。
下表可作为按体重调整剂量����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������的指南。