

山东罗欣药业集团股份有限公司招标公告
����� ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������Ƴ�������【规格】
(1)5ml:10mg(2)10ml:15����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������mg(3)20ml:30mg
【包 &����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������nbsp; 装】
中性硼硅玻璃安瓿:1支/����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������盒;2支/盒;5支/盒;6����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������支/盒;8支/盒;10支/盒。
【批准文号】
(1)5ml:10mg&n����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ������bsp;国药准字H20183189 ����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������;
(2)10ml:15mg 国药准字H����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������20183190 &n����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������bsp; &����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������nbsp; &nbs����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������p;
(3)20ml:30mg����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ������� 国药准字H20183����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������191
【药品名称】
通用名称:依达拉奉注射液
英文名称: Edaravone Inject����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ������ion
汉语拼音: Yidalafeng Zhushe����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������ye
【成份】本品主要成份为依达拉奉。
化学名称:3-甲基-1-苯基-2-吡唑啉-5-酮。
化学结构式:
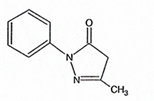
分子式:C10H10N2O
分子量:174.20
辅料为:亚硫酸氢钠、盐酸半胱氨酸、氯化钠、磷酸、氢氧化钠����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������、注射用水。
【性状】本品为无色或几乎无色的澄明液体。
【适应症】用于改善急性脑梗����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������死所致的神经症状、日常生活活动能����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������力和功能障碍。
【规格】(1)5ml:10mg(2)10ml:15mg(����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������3)20ml:30mg
【用法用量】
静脉滴注。一次30mg,临用前加入适量生理盐水中稀释����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������后静脉滴注,30分钟内滴完。每日两次,14日为一个疗程。尽可能在发病后24小时内开始给药。
【不良反应】
&nbs����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������p����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������; 据日本临床病例569例观察,26例(4.57%)出现不良反应。主要表现为肝功能异常16例(2.81%),皮疹4例(0.70%)。569例中临床检测值异常变化的有122例(21.4%),主要是AST上升7.71%(43/558),ALT上升8.23%(46/559)等肝功能检测值异常。
严重不良反应有:
����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������1、急性肾功能衰竭(程度不����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������明) 用药过程中进行多次肾功能检测并密切观����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������察,出现肾功能低下表现或少尿等症状时,����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������停止用药并正确处理。
2、肝功能异常、黄疸(均程度不明) 伴有AST、ALT、ALP、γ-GTP、LDH上升等肝功能异常和黄疸,用药过程����� �������Ƴ����������� �������Ƴ����������� �������Ƴ������������ �������Ƴ�������中需检测肝功能并密切观察,出现异常情况,停止给药����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������并正确处理。
����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������� 3、血小板减少(程度不明) 有血小板减少表现,用药过程中需密切观察,出����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������现异常情况,停止给药并正确处理。����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������
4����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������、弥漫性血管内凝血(DIC)(程度不明) 可出现弥漫性血管内凝血的表现,用����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������药过程中定期检测,出现疑为弥漫性血管内凝血����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������的实验室表现和临床症状时,����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������停止给药并进行正确处理。
其他不良反应(发生率)及主要表现为:
1、过敏症(0.1%~5%):主要表现为皮疹、潮红、����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������肿胀、疱疹、瘙痒感;
2、血细胞系统(0.1%~5%):主要表现为红细胞减少����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������、白细胞增多、白细胞减少、红����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������细胞压积值减少、血红蛋白减少、血小����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������板增加、血小板减少;
3、注射部位(0.1%~5%):主要表现为注射部位皮疹、红肿;
4、肝脏(发生率>5%):主要表现为AST升高、ALT升高、LDH升高、ALP升高、γ-GTP升高;
&nbs����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������p; 肝脏(发生率0.1%~5%):总胆红素升高、尿胆原����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������阳性、胆红素尿;
5、肾脏(0.1%~5%):主要表现为BUN升高,血清尿酸升高,血清尿酸下降����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������,蛋白尿、血尿、肌酐升高(程度����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������不明);
6、消化系统(0.1%~5%):嗳气;
7、其他(0.1%~5%):发热,热感,血压升高,血清胆固醇升高����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������,血清胆固醇降低,甘油三酯升高,血清����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������总蛋白减少,CK(CPK)降低,血清钾下降,血清钙下降。
【禁忌】
1、重度肾功能衰竭的患者(有����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������致肾功能衰竭加重的可能)。
2、既往对本品有过敏史的患者。
【注意事项】
1、轻、中度肾功能损害的患者慎用(有����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������致肾功能衰竭加重的可能)。
2、肝功能损害患����� �������Ƴ����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ��������������者慎用(有致肝功能损����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������害加重的可能)。
3、心脏疾病患者慎用(有致心脏病加����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������重的可能,或可能伴有肾功能����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������不全)。
4、高龄患者慎用。据日本厚生劳动省2002年10月28日安全性通报,该产品在日本上市销����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ������售15个月内,累计使用患者约146,000人,发生加重急性肾功能不全或肾功能����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������衰竭病例报告29例(约占0.02%),其中12人死亡,分别是50~60岁1人、70~80岁3人、80~90岁7人、90岁以上1人,是否与本品的使用有因果����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������关系尚不能确认;自此安全性通报后,未����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������再见有类似报道。建议临床使用本品时应对患者的肾����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������功能进行密切观察,在给药过程中进行����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������多次肾功能检测,出现肾功能下降的表现或少尿等症����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������状的情况下,立即停止给药,进行适当处理,����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������尤其针对年龄高于80岁的患者,应特别注意。
【孕妇及哺乳期妇女用药】
1、孕妇或有妊娠可能的妇女禁����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������用本品(尚不能确定关于妊娠期给药����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������的安全性)。
2、哺乳期的妇女禁用。必须����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������应用时,用药期间应停止哺乳(动物实验中有����� �������Ƴ����������� �������Ƴ����������� �������Ƴ������������ �������Ƴ�������向乳汁中分布的报告)。
【儿童用药】儿童不应使用本品(因没有使用经验,����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������尚不能确定儿童用药的安全性����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ������)。
【老年用药】
因老年患者生理机能低下,出现不良反应时����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������应停止给药并适当处理。一般����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������而言,高龄患者(80岁以上)应慎用。
【药物相互作用】
����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������ 1、与头孢唑啉钠、盐酸哌拉西林钠、头孢替安����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������钠等抗生素合用时,有致肾功能衰竭加重的可能,因此����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������合并用药时需进行多次肾功能检测����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������等观察。
2����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ������、本品原则上必须用生理盐水稀释(与各种含有糖分的����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������输液混合时,可使依达拉奉的浓度降低)。
3、不可和高能量的输液、氨基酸制剂混合或由同一通����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������道静滴(混合后可致依达拉奉的浓度����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ������降低)。
4����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������、勿与抗癫痫药(地西泮、苯妥����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������英钠等)混合(产生混浊)。
5、勿与坎利酸钾混合(产生混浊)。
【药物过量】未进行该项实验且无可靠参考文献。
【药理毒理】
药理作用
依达拉奉是一种脑保护剂(自由基清除剂)。����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������临床研究提示N-乙酰门冬氨酸(NAA)是特异性的存活神经细胞的标志,脑梗塞发病初期����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������含量急剧减少。脑梗塞急性期患����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������者给予依达拉奉,可抑制梗塞周围局部脑血流量的����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������减少,使发病后第28天脑中NAA含量较甘油对照组明显升高。临床前研究提示,大鼠在����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������缺血/缺血再灌注后静脉给予依达����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������拉奉,可阻止脑水肿和脑梗����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������塞的进展,并缓解所伴随的神经症状,����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������抑制迟发性神经元死亡。机����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������理研究提示,依达拉奉可清����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������除自由基,抑制脂质过氧化,从而抑制脑����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ������细胞、血管内皮细胞、神经细胞的氧����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������化损伤。
毒理研究
遗传毒性:依达拉奉Ames试验,CHL染色体畸变试验及��������� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������� �������Ƴ�������小鼠微核试验结����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������果均为阴性。
生殖毒性:一般生殖毒性试验中,大鼠给予依达拉奉����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������3、20、200mg/kg,20、200mg/kg组的动物出现尿色橙褐、流泪、流涎和自主活动减少,����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������体重和食量轻微下降;200mg/kg组雌鼠平均性周期延长,雌鼠、雄鼠生育力降低,胎仔����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������胸腺残留率升高。致畸敏感期毒����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������性试验中,妊娠大鼠静脉注射给予����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������依达拉奉3、30、300mg/kg,300mg/kg组母鼠摄食量下降,体重增加缓慢,给����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������药后出现伏卧、步态不稳、自发运动减少、流泪����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������等;各剂量组雄性胎仔体重及30mg/kg组雌性胎仔体重均低于对照组����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������;各剂量组胎仔内脏畸形率升高,����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������幼鼠耳廓展开、眼睑开裂、睾丸下垂、阴道开口有延迟����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������倾向。妊娠新西兰白兔静脉注射给予依达拉����� �������Ƴ������������ �������Ƴ����������� �������Ƴ����������� �������Ƴ������奉3、20、100mg/kg,100mg/kg组动物出现尿液橙褐色、步态失调、流泪、瞳孔缩小����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������、呼吸异常、后肢麻痹、给药部位充����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������血、水肿、坏死及炎症;3、100mg/kg组动物胎盘重量增加。围产期毒性试验中,妊娠Wistar大鼠静脉注射给予依达拉奉����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������3、20、200mg/kg,200mg/kg组动物给药期间,摄食量下降,体重增加量降低,出����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������现摇头、眨眼、流泪、自发����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������运动减少等症状。幼鼠出生����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������后28天旷场实验结果显示20、200mg/kg组幼鼠移动次数增高。
【药代动力学】
据国外文献报道
血药浓度 健康成年男性受试者(5例)和65岁以上健康老年受试者(5例),以0.5mg/kg体重剂量,1日2次,每次30分钟内静脉滴注,连续给药2天后,血浆中药物浓度的变化和以起����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������始给药时的血浆药物浓度变化所����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������求得参数,如下图、表所示。
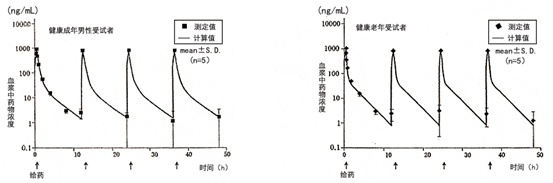
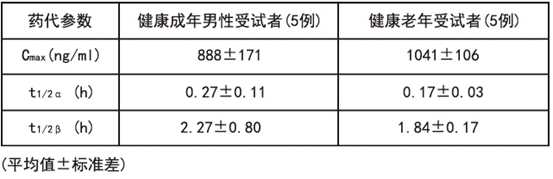
����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������� 健康成年男性受试者和健康老年受试者两者血����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������浆中药物浓度几乎都同样消失,没有蓄积性。����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������
&����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������nbsp; 血清蛋白结合率 体外试验结果表明:依达拉奉的人血清蛋白和人血清白����� �������Ƴ����������� �������Ƴ����������� �������Ƴ������������ �������Ƴ������蛋白结合率分别为92%和89%~91%。
代谢 在健康成年男性受试者和健康老年受试者中的����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ������研究结果表明:依达拉奉在血浆中的代谢物为硫����� �������Ƴ����������� �������Ƴ������������ �������Ƴ����������� �������Ƴ�������酸络合物、葡葡糖醛酸络合����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������物。在尿中主要代谢物为葡葡糖醛酸络合物����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������、硫酸络合物。
&����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������nbsp; 排泄 健康成年男性受试者和健康老年����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������受试者使用本品1日2次,每次0.5mg/kg,30分钟内静滴,连续2天给药,每次给药至12小时排泄尿液中含 0.7%~0.9%原药,71.0%~79.9%代谢物。
【贮 &nbs����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������p; 藏】遮光,密闭保存。
【包 装】中性硼硅玻璃安瓿:1支/盒;2支/盒;5支/盒;����� �������Ƴ�������� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�����������6支/盒;8支/盒;10支/盒。
【有 效 期】18个月
【执行标准】YBH01412018
【批准文号】(1)5ml:10mg 国药准字H20183189 (2)10ml:15mg 国药准字H20183190
&nb����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������sp; &����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������nbsp; &����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ������nbsp; &n����� �������Ƴ������������ �������Ƴ������������ �������Ƴ����������� �������Ƴ�������bsp; (3)20ml:30mg 国药准字H20183191
【生产企业】
企业名称:山东罗欣药业集团股份有限公司
生产地址:山东省临沂高新技术产业开发����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������区罗七路
邮政编码:276017
联系电话:0539-8257899&nb����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ�������sp; 8481991
传真电话:0539-8481990
售后服务:0539-8242699
网 ����� �������Ƴ������������ �������Ƴ������������ �������Ƴ������������ �������Ƴ������� 址:www.luoxin.cn
用于改善急性脑梗死所致的神经症状����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������、日常生活活动能力和功能障碍。
&����� �������Ƴ����������� �������Ƴ������������ �������Ƴ������������ �������Ƴ�������nbsp;
静脉滴注。一次30mg,临用前加入适量生理盐水中稀释后����� �������Ƴ������������ �������Ƴ����������� �������Ƴ������������ �������Ƴ�������静脉滴注,30分钟内滴完。每日两次,14日为一个疗程。尽可能在发病后24小时内开始给药。